Page 17 - KİMYA-11
P. 17
Ortaöğretim Genel Müdürlüğü KİMYA 11 6
1.ÜNİTE>Modern Atom Teorisi
Kazanım: 11.1.3.1. Periyodik özelliklerdeki değişim eğilimlerini sebepleriyle açıklar.
c. Ardışık iyonlaşma enerjilerinin grup numarasıyla ilişkisi örneklerle gösterilir.
Genel Beceriler: Bilgi Okuryazarlığı Becerisi Alan Becerileri: Çıkarım Yapma Becerisi
Etkinlik İsmi BİRİNCİ İYONLAŞMA ENERJİSİ 20 dk.
Amacı İyonlaşma enerjisi ile ilgili çıkarım yapabilme Bireysel
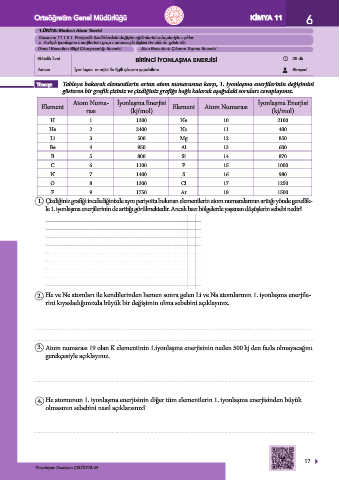
Yönerge Tabloya bakarak elementlerin artan atom numarasına karşı, 1. iyonlaşma enerjilerinin değişimini
gösteren bir grafik çiziniz ve çizdiğiniz grafiğe bağlı kalarak aşağıdaki soruları cevaplayınız.
Atom Numa- İyonlaşma Enerjisi İyonlaşma Enerjisi
Element Element Atom Numarası
rası (kj/mol) (kj/mol)
H 1 1300 Ne 10 2100
He 2 2400 Na 11 400
Li 3 500 Mg 12 850
Be 4 950 Al 13 600
B 5 800 Si 14 870
C 6 1100 P 15 1000
N 7 1400 S 16 980
O 8 1300 Cl 17 1250
F 9 1750 Ar 18 1500
1. Çizdiğiniz grafiği incelediğinizde aynı periyotta bulunan elementlerin atom numaralarının arttığı yönde genellik-
le 1. iyonlaşma enerjilerinin de arttığı görülmektedir. Ancak bazı bölgelerde yaşanan düşüşlerin sebebi nedir?
2. He ve Ne atomları ile kendilerinden hemen sonra gelen Li ve Na atomlarının 1. iyonlaşma enerjile-
rini kıyasladığımızda büyük bir değişimin olma sebebini açıklayınız.
3. Atom numarası 19 olan K elementinin 1.iyonlaşma enerjisinin neden 500 kj den fazla olmayacağını
gerekçesiyle açıklayınız.
4. He atomunun 1. iyonlaşma enerjisinin diğer tüm elementlerin 1. iyonlaşma enerjisinden büyük
olmasının sebebini nasıl açıklarsınız?
17
Hazırlayan: Denizhan ÇELİKKIRAN