Page 153 - Kimya 10 | Kavram Öğretimi Kitabı
P. 153
98
KİMYA 10
3. ÜNİTE : ASİTLER, BAZLAR VE TUZLAR > 3.2. Asitlerin ve Bazların Tepkimeleri > 3.2.1. Asitler ve Bazlar Arasındaki Tepkimeler
Kavram : Nötralleşme
Genel Beceriler : Eleştirel Düşünme Becerisi
Alan Becerileri : Çıkarım Yapma Becerisi
Çalışmanın Adı YANGINI SÖNDÜRELİM 10 dk.
Çalışmanın Amacı Nötralleşme kavramını tanımlayabilme.
Yönerge: Verilen bilgilerden yararlanarak soruları cevaplayınız.
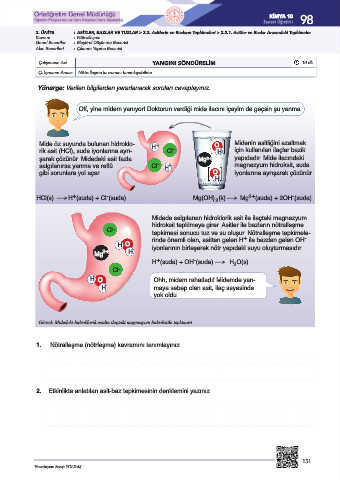
Off, yine midem yanıyor! Doktorun verdiği mide ilacını içeyim de geçsin şu yanma.
Mide öz suyunda bulunan hidroklo- + O Midenin asitliğini azaltmak
H -
rik asit (HCl), suda iyonlarına ayrı- Cl H için kullanılan ilaçlar bazik
şarak çözünür. Midedeki asit fazla Mg 2+ yapıdadır. Mide ilacındaki
salgılanırsa yanma ve reflü Cl - H + magnezyum hidroksit, suda
gibi sorunlara yol açar. O iyonlarına ayrışarak çözünür.
H
+ - 2+ -
HCl(s) → H (suda) + Cl (suda) Mg(OH) (k) → Mg (suda) + 2OH (suda)
2
Midede salgılanan hidroklorik asit ile ilaçtaki magnezyum
hidroksit tepkimeye girer. Asitler ile bazların nötralleşme
Cl - tepkimesi sonucu tuz ve su oluşur. Nötralleşme tepkimele-
+ -
rinde önemli olan, asitten gelen H ile bazdan gelen OH
H O iyonlarının birleşerek nötr yapıdaki suyu oluşturmasıdır.
Mg 2+ H
+ -
H (suda) + OH (suda) → H O(s)
2
Cl -
H O Ohh, midem rahatladı! Midemde yan-
H maya sebep olan asit, ilaç sayesinde
yok oldu.
Görsel: Midedeki hidroklorik asidin ilaçtaki magnezyum hidroksitle tepkimesi
1. Nötralleşme (nötrleşme) kavramını tanımlayınız.
2. Etkinlikte anlatılan asit-baz tepkimesinin denklemini yazınız.
151
Hazırlayan: Serap YOLDAŞ