Page 11 - Kimya 9 | Kazanım Kavrama Etkinlikleri
P. 11
3 KİMYA 9 Ortaöğretim Genel Müdürlüğü
3. Aşağıda bazı bileşik çiftleri verilmiştir.
I. NH 3 – HF
II. C 6 H 12 O 6 – H 2 O
III. NaCl – H 2 O
IV. CO 2 – H 2 S
Bileşik çiftlerinden hangilerinde molekül arası hidrojen bağları bulunur? Açıklayınız.
3. Yönerge Hidrojen bağının kaynama noktasına etkisi açıklanır.
Moleküller arası çekim kuvvetleri bir maddenin fiziksel özellikleri üzerinde etkilidir. Katı bir maddeyi sıvı hâle
getirmek veya bir sıvıyı buharlaştırmak için moleküller arası (zayıf etkileşim) çekim kuvvetlerini yenmeye yetecek
kadar enerji gerekir. Bu çekim kuvvetlerini yenmek onları bir arada tutan kuvvetten daha büyük bir enerji vermekle
mümkün olur. Moleküller arası çekim kuvvetleri ne kadar büyük olursa kullanılması gereken enerji de o kadar fazla
olur.
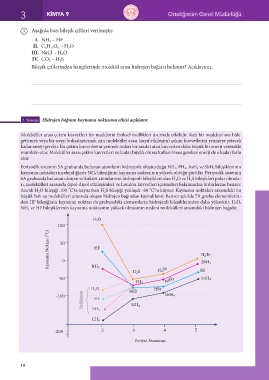
Periyodik sistemin 5A grubunda bulunan atomların hidrojenle oluşturduğu NH 3, PH 3, AsH 3 ve SbH 3 bileşiklerinin
kaynama noktaları incelendiğinde NH 3 bileşiğinin kaynama noktasının yüksek olduğu görülür. Periyodik sistemin
6A grubunda bulunan oksijen ve kükürt atomlarının hidrojenli bileşikleri olan H 2O ve H 2S bileşikleri polar olmala-
rı, molekülleri arasında dipol-dipol etkileşimleri ve London kuvvetleri içermeleri bakımından birbirlerine benzer.
o
o
Ancak H 2O bileşiği 100 C’ta kaynarken H 2S bileşiği yaklaşık -60 C’ta kaynar. Kaynama noktaları arasındaki bu
büyük fark su molekülleri arasında oluşan hidrojen bağından kaynaklanır. Benzer şekilde 7A grubu elementlerin-
den HF bileşiğinin kaynama noktası da grubundaki elementlerin hidrojenli bileşiklerinden daha yüksektir. H 2O,
NH 3 ve HF bileşiklerinin kaynama noktasının yüksek olmasının nedeni molekülleri arasındaki hidrojen bağıdır.
H 2 O
100
Kaynama Noktası ( o C) 50 HF H 2 Te
0
SbH 3
NH 3
H 2 S H 2 Se HI
-50 AsH 3 SnH 4
PH 3
H 2 O HCl HBr
Beklenen HF
-100 GeH 4
NH 3 SiH 4
CH 4
-200 2 3 4 5
Periyot Numarası
10