Page 21 - 3 Adım AYT Kimya
P. 21
KİMYA
AYT 3.
Atomun Kuantum Modeli - Periyodik Sistem ADIM
ve Elektron Dizilimleri - A
9
4
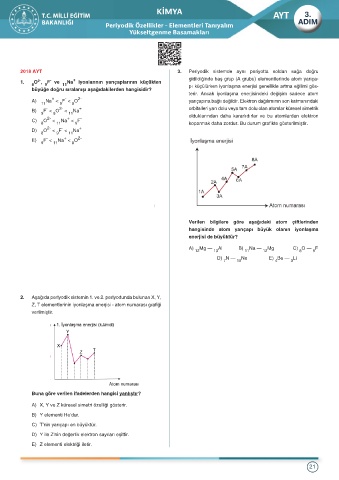
2019 AYT 4. Temel hâlde bir atomun orbital dağılımı 3d ve 3d ile bitemez.
1. Temel durumdaki 5 B atomundaki elektronların baş Küresel simetri özelliği kazanmak için 4s orbitalinden bir
kuantum (n), açısal momentum kuantum (¬), manyetik elektron kendiliğinden 3d orbitaline geçer.
kuantum (m ) ve spin kuantum (m ) sayılarıyla ilgili
s
¬
aşağıdakilerden hangisi doğrudur? Grafikte X atomunun 3. ve 4. katman ve alt katmanlarının
enerji düzeyleri gösterilmiştir.
A) Değerlik elektronları için n değeri 1’dir.
B) Dört tane elektronun ¬ değeri 0’dır.
C) Birinci enerji düzeyinde bulunan elektronlar için ¬ değeri
1’dir.
D) İkinci enerji düzeyinde bulunan elektronlar için m değeri
¬
+2’dir.
E) Dört tane elektronun m değeri +�’dir.
s
2020 AYT
2. Temel hâldeki bir atomun enerji seviyesi en yüksek orbitalinde
1 elektron vardır ve bu elektronun kuantum sayıları aşağıda
Buna göre,
verilmiştir.
I. X atomu uyarılmıştır.
• Baş kuantum sayısı (n) = 4
II. X atomunun temel hâl elektron diziliminde m = +1 olan
• Açısal momentum kuantum sayısı (¬) = 0 ¬
toplam 6 tane elektron vardır.
Bu atomda manyetik kuantum sayısı (m ) = 0 olan toplam
¬
kaç elektron vardır? III. ¬= 0 kuantum sayısına sahip toplam 8 tane elektron vardır.
yargılarından hangileri yanlıştır?
A) 7 B) 9 C) 10 D) 11 E) 12
A) Yalnız I B) I ve II C) I ve III
3. Kuantum sayıları orbitallerin ve orbitallerde yer alan elektronların D) II ve III E) I, II ve III
belirlenmesinde kullanılır. Başlıca kuantum sayıları şunlardır:
1. Baş kuantum sayısı (n) : Elektronun enerji düzeyine ve 5.
elektronun çekirdeğe olan ortalama uzaklığına bağlı
olarak değişen kuantum sayısıdır. Açısal momentum 0 1 2 3
kuantum sayısı (¬)
2. Açısal momentum kuantum sayısı (¬) : Orbitalin şeklini ve
Orbital türü s p d f
bir enerji düzeyinde kaç tane alt enerji düzeyi olduğunu
gösteren kuantum sayısıdır. (¬= 0,1... (n-1))
Orbitallerin enerji değerleri n+¬ değerinin artmasıyla yükselir.
3. Manyetik kuantum sayısı (m ) : Alt enerji düzeyinde
¬
kaç tane orbital olduğunu gösteren kuantum sayısıdır. Aynı n+¬ değerine sahip olan orbitallerden n değeri büyük
olanın enerji değeri de büyük olur.
(m = 2 ¬ +1 ya da m = - ¬, 0, + ¬)
¬ ¬
Buna göre atomdaki bir elektron aşağıda verilen kuantum sa- Buna göre 4f, 2s, 3d, 5p, 6s orbitallerinin enerjilerinin
yılarından hangisine sahip olamaz? büyükten küçüğe doğru sıralanışı aşağıdakilerden
hangisidir?
n ¬ m
¬ A) 2s, 3d, 4f, 5p, 6s
A) 4 3 +1
B) 6s, 5p, 4f, 3d, 2s
B) 3 1 0
C) 4f, 6s, 5p, 3d, 2s
C) 2 1 -1
D) 1 0 0 D) 6s, 2s, 5p, 3d, 4f
E) 3 3 -2 E) 4f, 5p, 3d, 6s, 2s
19