Page 8 - Kimya 9 | Çalışma Defteri-4
P. 8
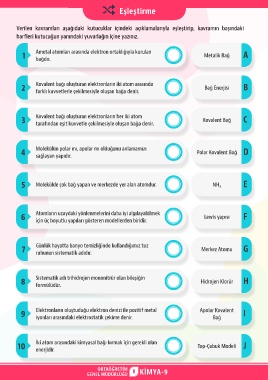
Eşleştirme
Verilen kavramları aşağıdaki kutucuklar içindeki açıklamalarıyla eşleştirip, kavramın başındaki
harfleri kutucuğun yanındaki yuvarlağın içine yazınız.
1 Ametal atomları arasında elektron ortaklığıyla kurulan Metalik Bağ A
bağdır.
2 Kovalent bağı oluşturan elektronların iki atom arasında Bağ Enerjisi B
farklı kuvvetlerle çekilmesiyle oluşan bağa denir.
3 Kovalent bağı oluşturan elektronların her iki atom Kovalent Bağ C
tarafından eşit kuvvetle çekilmesiyle oluşan bağa denir.
4 Molekülün polar mı, apolar mı olduğunu anlamamızı Polar Kovalent Bağ D
sağlayan yapıdır.
5 Molekülde çok bağ yapan ve merkezde yer alan atomdur. NH₃ E
6 Atomların uzaydaki yönlenmelerini daha iyi algılayabilmek Lewis yapısı F
için üç boyutlu yapıları gösteren modellerden biridir.
7 Günlük hayatta banyo temizliğinde kullandığımız tuz Merkez Atomu G
ruhunun sistematik adıdır.
8 Sistematik adı trihidrojen mononitrür olan bileşiğin Hidrojen Klorür H
formülüdür.
9 Elektronların oluştuduğu elektron denizi ile pozitif metal Apolar Kovalent I
Bağ
iyonları arasındaki elektrostatik çekime denir.
10 İki atom arasındaki kimyasal bağı kırmak için gerekli olan Top-Çubuk Modeli J
enerjidir.
ORTAÖĞRETİM 8 KİMYA-9
GENEL MÜDÜRLÜĞÜ