Page 24 - Kimya 11 | Çalışma Defteri -7
P. 24
Beceri Temelli - II
HIZLI MI? YAVAŞ MI?
1. Yönerge: Aşağıdaki bilgilerden faydalanarak soruları cevaplayınız.
Bir kimyasal tepkimede birim zamanda harcanan veya oluşan madde miktarının değişimine tepkime hızı denir. Çarpışma
teorisine göre etkin çarpışma sayısı arttıkça tepkime hızı artar. Tepkime ilerledikçe girenler ürünlere dönüştüğü için
ortamdaki tepkimeye giren madde miktarı azalır. Bu nedenle tepkime ilerledikçe tepkime hızı azalır. Bir tepkimenin
hızını izleyebilmek için giren maddelerle ürünlerin birbirinden farklı olan renk, çökelti oluşumu, elektrik iletkenliği,
basınç, hacim, sıcaklık gibi bazı özelliklerinden yararlanılır.
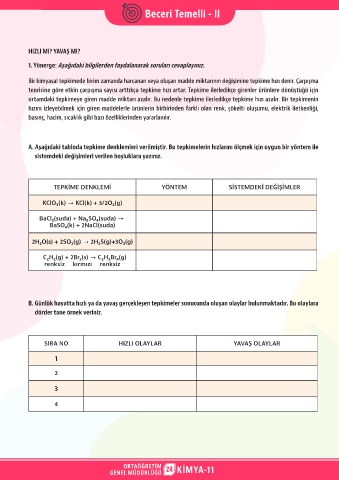
A. Aşağıdaki tabloda tepkime denklemleri verilmiştir. Bu tepkimelerin hızlarını ölçmek için uygun bir yöntem ile
sistemdeki değişimleri verilen boşluklara yazınız.
TEPKİME DENKLEMİ YÖNTEM SİSTEMDEKİ DEĞİŞİMLER
KClO₃(k) KCl(k) + 3/2O₂(g)
BaCl₂(suda) + Na₂SO₄(suda)
BaSO₄(k) + 2NaCl(suda)
2H₂O(s) + 2SO₂(g) 2H₂S(g)+3O₂(g)
C₂H₂(g) + 2Br₂(s) C₂H₂Br₄(g)
renksiz kırmızı renksiz
B. Günlük hayatta hızlı ya da yavaş gerçekleşen tepkimeler sonucunda oluşan olaylar bulunmaktadır. Bu olaylara
dörder tane örnek veriniz.
SIRA NO HIZLI OLAYLAR YAVAŞ OLAYLAR
1
2
3
4
ORTAÖĞRETİM 24 KİMYA-11
GENEL MÜDÜRLÜĞÜ