Page 304 - Dört Dörtlük Konu Pekiştirme Testi - AYT KİMYA
P. 304
Elektrokimyasal Hücreler - Elektrot Potansiyelleri - Elektroliz -
KİMYA Korozyon 1. TEST - A
o
+
-
0
6. Cr (suda)+ 3e † Cr(k) E = -0,40 V 8. 2Ag (suda) + Zn (k) † Zn (suda) + 2Ag (k) E = 1,56 V pil
2+
3+
pil
denklemi verilmektedir.
2+
Sn(k)→Sn (suda) + 2e - E = 0,13 V
o
+
Bu galvanik pilde [Ag ]=0,01 M, [Zn ]=0,1 M olduğuna
2+
2+
Zn (suda) + 2e † Zn(k) E = -0,76 V
-
o
göre pil potansiyeli kaç volttur?
Al(k) →Al (suda) + 3e E = 1,66 V (Nernst denkleminde logaritmik terimin katsayısı 0,06 alınacaktır.)
-
3+
o
Yukarıda verilen yarı pil potansiyellerine göre A) 0,046 B) 0,46 C) 1,47 D) 1,53 E) 1,56
2+
3+
I. Al (suda) + Zn(k) † Zn (suda) + Al(k)
II. Cr(k) + Sn (suda) † Cr (suda) + Sn(k)
2+
3+
3+
2+
III. Zn(k) + Cr (suda) † Zn (suda) + Cr(k)
tepkimelerinden hangileri kendiliğinden gerçekleşir?
A) Yalnız I B) Yalnız II C)Yalnız III
D) I ve II E) II ve III
9. Lityum iyon pilleri için aşağıdakilerden hangisi söylenemez?
A) Elektrik enerjisini kimyasal enerjiye dönüştürür.
B) Cep telefonlarında ve tabletlerde kullanılır.
C) Uzun ömürlüdürler.
D) Yüksek sıcaklıklarda kullanılabilir.
E) Enerji veriimi yüksektir.
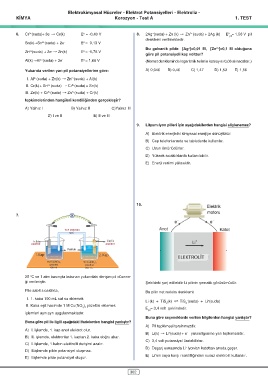
10.
7.
V Elektrik motoru
e – e –
Tuz köprüsü
Anot Katot
NaNO 3
Cu(k) Cu(k)
elektrot elektrot
Li +
Pamuk
1. Kap 2. Kap
ELEKTROLİT
1 M Cu(NO ) çözeltisi 1 M Cu(NO ) çözeltisi
3 2
3 2
100 mL 200 mL
25 °C ve 1 atm basınçta bulunan yukarıdaki derişim pil düzene-
ği verilmiştir.
Şekildeki şarj edilebilir Li pilinin şematik görünümüdür.
Pile sabit sıcaklıkta,
Bu pilin net redoks denklemi:
I. 1. kaba 100 mL saf su eklemek
+
Li (k) + TiS (k) ø TiS (suda) + Li (suda)
-
II. 2. kaba eşit hacimde 1 M Cu(NO ) çözeltisi eklemek 2 2
3 2
E = 3,4 volt şeklindedir.
işlemleri ayrı ayrı uygulanmaktadır. pil
Buna göre seçeneklerde verilen bilgilerden hangisi yanlıştır?
Buna göre pil ile ilgili aşağıdaki ifadelerden hangisi yanlıştır?
A) Pil tepkimesi tersinmezdir.
A) I. işlemde, 1. kap anot elektrot olur.
-
+
B) Li(k) † Li (suda) + e yükseltgenme yarı tepkimesidir.
B) II. işlemde, elektronlar 1. kaptan 2. kaba doğru akar.
C) I. işlemde, 1.kabın elektrolit derişimi azalır. C) 3,4 volt potansiyel üretebilirler.
+
D) II.işlemde pilde potansiyel oluşmaz. D) Deşarj esnasında Li iyonları katottan anoda geçer.
E) I.işlemde pilde potansiyel oluşur. E) Li’nin suya karşı reaktifliğinden susuz elektrolit kullanılır.
302