Page 78 - Dört Dörtlük Konu Pekiştirme Testi - TYT KİMYA
P. 78
KİMYA Periyodik Sistem ÇÖZÜMLÜ SORULAR
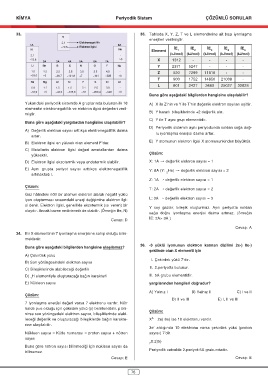
33. 35. Tabloda X, Y, Z, T ve L elementlerine ait bazı iyonlaşma
enerjileri verilmiştir.
İE İE İE İE İE
3
2
1
Element
5
4
(kJ/mol) (kJ/mol) (kJ/mol) (kJ/mol) (kJ/mol)
X 1312 - - - -
Y 2371 5247 - - -
Z 520 7299 11816 - -
T 900 1752 14850 21008 -
L 801 2427 3660 25027 32828
Buna göre aşağıdaki bilgilerden hangisine ulaşılabilir?
Yukarıdaki periyodik sistemde A gruplarında bulunan ilk 18 A) X ile Z’nin ve Y ile T’nin değerlik elektron sayıları eşittir.
elementin elektronegatiflik ve elektron ilgisi değerleri veril-
B) Y kararlı bileşiklerinde +2 değerlik alır.
miştir.
C) Y ile T aynı grup elementidir.
Buna göre aşağıdaki yargılardan hangisine ulaşılabilir?
D) Periyodik sistemin aynı periyodunda soldan sağa doğ-
A) Değerlik elektron sayısı arttıkça elektronegatiflik daima
ru iyonlaşma enerjisi daima artar.
artar.
B) Elektron ilgisi en yüksek olan element F’dur. E) Y atomunun elektron ilgisi X atomununkinden büyüktür.
C) Metallerin elektron ilgisi değeri ametallerden daima
yüksektir. Çözüm:
D) Elektron ilgisi ekzotermik veya endotermik olabilir. X: 1A † değerlik elektron sayısı = 1
E) Aynı grupta periyot sayısı arttıkça elektronegatiflik Y: 8A (Y: He) † değerlik elektron sayısı = 2
artmaktadır. 2
Z: 1A † değerlik elektron sayısı = 1
Çözüm:
T: 2A † değerlik elektron sayısı = 2
Gaz hâlindeki nötr bir atomun elektron alarak negatif yüklü
iyon oluşturması sırasındaki enerji değişimine elektron ilgi- L: 3A † değerlik elektron sayısı = 3
si denir. Elektron ilgisi, genellikle ekzotermik (ısı veren) bir
Y soy gazdır, bileşik oluşturmaz. Aynı periyotta soldan
olaydır. Ancak bazen endotermik de olabilir. (Örneğin Be, N)
sağa doğru iyonlaşma enerjisi daima artmaz. (örneğin
İE: 2A> 3A )
Cevap: D
Cevap: A
34. Bir X elementinin 7 iyonlaşma enerjisine sahip olduğu bilin-
mektedir.
36. -3 yüklü iyonunun elektron katman dizilimi 2e-) 8e-)
Buna göre aşağıdaki bilgilerden hangisine ulaşılamaz?
şeklinde olan X elementi için
A) Çekirdek yükü
I. Çekirdek yükü 7’dir.
B) Son yörüngesindeki elektron sayısı
II. 2.periyotta bulunur.
C) Bileşiklerinde alabileceği değerlik
D) H elementiyle oluşturacağı bağın karakteri III. 5A grubu elementidir.
1
E) Nükleon sayısı yargılarından hangileri doğrudur?
A) Yalnız I B) Yalnız II C) I ve II
Çözüm:
D) II ve III E) I, II ve III
7 iyonlaşma enerjisi değeri varsa 7 elektronu vardır. Nötr
halde p=e olduğu için çekirdek yükü (p) belirlenebilir. p bili-
Çözüm:
nirse son yörüngedeki elektron sayısı, bileşiklerinde alabi-
leceği değerlik ve oluşturacağı bileşiklerde bağın karakte- X 3- 2e) 8e) ise 10 elektronu vardır.
rine ulaşılabilir. -
3e aldığında 10 elektronu varsa çekirdek yükü (proton
Nükleon sayısı = Kütle numarası = proton sayısı + nötron sayısı) 7’dir.
sayısı
X:2)5)
7
Buna göre nötron sayısı bilinmediği için nükleon sayısı da
Periyodik cetvelde 2.periyot-5A grubundadır.
bilinemez.
Cevap: E Cevap: E
76