Page 88 - Dört Dörtlük Konu Pekiştirme Testi - TYT KİMYA
P. 88
KİMYA Periyodik Sistem 2. TEST - B
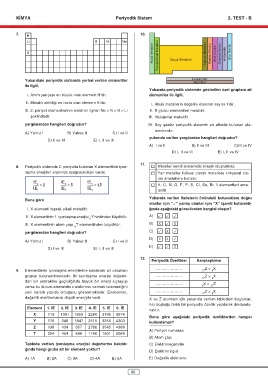
7. 10.
H
Li B N Ne
Alkali Metaller ToprakAlkali Metaller Geçiş Metalleri Toprak Metalleri Karbon Grubu Azot Grubu Oksijen Grubu Halojenler
K Soy Gazlar
Yukarıdaki periyodik sistemde yerleri verilen elementler Lantanitler
Aktinitler
ile ilgili,
Yukarıda periyodik sistemde gösterilen özel gruplara ait
I. Atom yarıçapı en büyük olan element H’dir. elementler ile ilgili,
II. Metalik aktifliği en fazla olan element K’dır. I. Alkali metallerin değerlik elektron sayısı 1’dir.
III. 2. periyot elementlerinin elektron ilgileri Ne > N > B > Li II. B grubu elementleri metaldir.
şeklindedir. III. Halojenler metaldir.
yargılarından hangileri doğrudur? IV. Soy gazlar periyodik sistemin en altında bulunan ele-
mentlerdir.
A) Yalnız I B) Yalnız II C) I ve II
yukarıda verilen yargılardan hangileri doğrudur?
D) II ve III E) I, II ve III
A) I ve II B) II ve III C)III ve IV
D) I, II ve III E) I, II ve IV
11.
8. Periyodik sistemde 2. periyotta bulunan X elementinin iyon- Metaller kendi aralarında bileşik oluşturmaz.
laşma enerjileri arasında aşağıdaki ilişki vardır. Yarı metaller fiziksel olarak metallere kimyasal ola-
rak ametallere benzer.
İ.E İ.E İ.E
2 = 2 3 = 5 4 = 1,5 H, C, N, O, F, P, S, Cl, Se, Br, I elementleri ame-
İ.E İ.E İ.E
1 2 3 taldir.
Yukarıda verilen ifadelerin önündeki kutucuklara doğru
Buna göre
olanlar için “✓” yanlış olanlar için “X” işareti kullanıldı-
I. X elementi toprak alkali metaldir. ğında aşağıdaki görsellerden hangisi oluşur?
II. X elementinin 1. iyonlaşma enerjisi Y’ninkinden küçüktür. A) ✓ ✓ ✓
5
III. X elementinin atom çapı T elementinden büyüktür. B) X ✓ X
6
yargılarından hangileri doğrudur? C) ✓ X ✓
D) X X ✓
A) Yalnız I B) Yalnız II C) I ve II
E) ✓ ✓ X
D) I ve III E) I, II ve III
12.
Periyodik Özellikler Karşılaştırma
…………………. Z > X
9. Elementlerin iyonlaşma enerjilerine bakılarak ait oldukları 17 9
gruplar bulunabilmektedir. Bir iyonlaşma enerjisi değerin- …………………. Z > X
17 9
den bir sonrakine geçildiğinde büyük bir enerji sıçrayışı
…………………. X > Z
varsa bu durum elementin o elektronu vermek istemediğini 9 17
yani kararlı yapıda olduğunu göstermektedir. Elementler, …………………. 17 Z > X
9
değerlik elektronlarını düşük enerjiyle verir. X ve Z atomları için yukarıda verilen tablodaki boşluklar,
her boşluğa farklı bir periyodik özellik yazılarak doldurula-
Element 1. İE 2. İE 3. İE 4. İE 5. İE 6. İE
caktır.
X 119 1091 1650 2280 3195 3974
Buna göre aşağıdaki periyodik özelliklerden hangisi
Y 176 348 1847 2515 3255 4303
kullanılamaz?
Z 138 434 657 2766 3545 4389
A) Periyot numarası
T 254 454 696 1166 1501 5089
B) Atom çapı
Tabloda verilen iyonlaşma enerjisi değerlerine bakıldı- C) Elektronegativite
ğında hangi gruba ait bir element yoktur?
D) Elektron ilgisi
A) 1A B) 2A C) 3A D) 4A E) 5A E) Değerlik elektronu
86