Page 31 - Kimya 10| Kavram Öğretimi Kitabı
P. 31
17
KİMYA 11
1. ÜNİTE : MODERN ATOM TEORİSİ > 1.2. Periyodik Sistem ve Elektron Dizilimleri > 1.2.1. Nötr Atomların Elektron Dizilimleri
ve Periyodik Sistemdeki Yerleri
Kavram : Elektron Dizilimi
Genel Beceriler : Bilgi Okuryazarlığı Becerisi
Alan Becerileri : Ölçme Becerisi
Çalışmanın Adı ELEKTRON DİZİLİMİ 20 dk.
Çalışmanın Amacı Elementlerin elektron dizilimlerini yapabilme.
Yönerge: Aşağıda verilen bilgilerden yararlanarak soruları cevaplayınız.
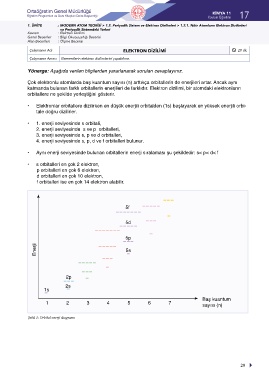
Çok elektronlu atomlarda baş kuantum sayısı (n) arttıkça orbitallerin de enerjileri artar. Ancak aynı
katmanda bulunan farklı orbitallerin enerjileri de farklıdır. Elektron dizilimi, bir atomdaki elektronların
orbitallere ne şekilde yerleştiğini gösterir.
• Elektronlar orbitallere dizilirken en düşük enerjili orbitalden (1s) başlayarak en yüksek enerjili orbi-
tale doğru dizilirler.
• 1. enerji seviyesinde s orbitali,
2. enerji seviyesinde s ve p orbitalleri,
3. enerji seviyesinde s, p ve d orbitalleri,
4. enerji seviyesinde s, p, d ve f orbitalleri bulunur.
• Aynı enerji seviyesinde bulunan orbitallerin enerji sıralaması şu şekildedir: s< p< d< f
• s orbitalleri en çok 2 elektron,
p orbitalleri en çok 6 elektron,
d orbitalleri en çok 10 elektron,
f orbitalleri ise en çok 14 elektron alabilir.
5f
5d
5p
Enerji 5s
2p
2s
1s
Baş kuantum
1 2 3 4 5 6 7
sayısı (n)
Şekil 1: Orbital enerji diagramı
29