Page 33 - Kimya 10| Kavram Öğretimi Kitabı
P. 33
18
KİMYA 11
1. ÜNİTE : MODERN ATOM TEORİSİ > 1.2. Periyodik Sistem ve Elektron Dizilimleri > 1.2.1. Nötr Atomların Elektron Dizilimleri
ve Periyodik Sistemdeki Yerleri
Kavram : Elektron Dizilimi
Genel Beceriler : Eleştirel Düşünme Becerisi
Alan Becerileri : Çıkarım Yapma Becerisi
Çalışmanın Adı ELEKTRONLARI YERLEŞTİRME 20 dk.
Çalışmanın Amacı Elektron dizilimi kurallarını uygulayabilme.
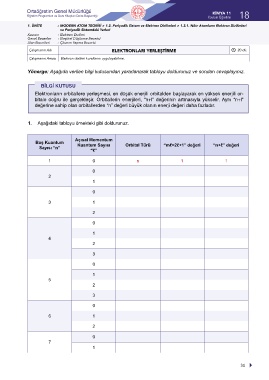
Yönerge: Aşağıda verilen bilgi kutusundan yararlanarak tabloyu doldurunuz ve soruları cevaplayınız.
BİLGİ KUTUSU
Elektronların orbitallere yerleşmesi, en düşük enerjili orbitalden başlayarak en yüksek enerjili or-
bitale doğru ile gerçekleşir. Orbitallerin enerjileri, “n+l” değerinin artmasıyla yükselir. Aynı “n+l”
değerine sahip olan orbitallerden “n” değeri büyük olanın enerji değeri daha fazladır.
1. Aşağıdaki tabloyu örnekteki gibi doldurunuz.
Açısal Momentum
Baş Kuantum
Sayısı “n” Kuantum Sayısı Orbital Türü “mℓ=2ℓ+1” değeri “n+ℓ” değeri
“ℓ”
1 0 s 1 1
0
2
1
0
3 1
2
0
1
4
2
3
0
1
5
2
3
0
6 1
2
0
7
1
31