Page 39 - Kimya 10| Kavram Öğretimi Kitabı
P. 39
22
KİMYA 11
1. ÜNİTE : MODERN ATOM TEORİSİ> 1.2. Periyodik Sistem ve Elektron Dizilimleri> 1.2.1. Nötr Atomların Elektron Dizilimleri ve
Periyodik Sistemdeki Yerleri
Kavram : Değerlik Orbitali ve Değerlik Elektronu
Genel Beceriler : Bilgi Okuryazarlığı Becerisi
Alan Becerileri : Çıkarım Yapma Becerisi
Çalışmanın Adı PLATFORM 15 dk.
Çalışmanın Amacı Değerlik orbitali ve değerlik elektron kavramlarını ayırt edebilme.
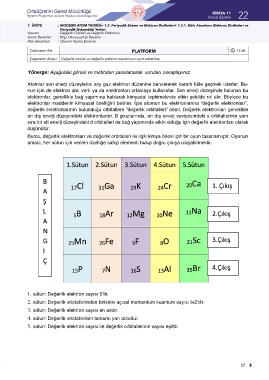
Yönerge: Aşağıdaki görsel ve metinden yararlanarak soruları cevaplayınız.
Atomlar son enerji düzeylerini soy gaz elektron düzenine benzeterek kararlı hâle geçmek isterler. Bu-
nun için de elektron alır, verir ya da elektronları ortaklaşa kullanırlar. Son enerji düzeyinde bulunan bu
elektronlar, genellikle bağ yapımına katılarak kimyasal tepkimelerde etkin şekilde rol alır. Böylece bu
elektronlar maddenin kimyasal özelliğini belirler. İşte atomun bu elektronlarına “değerlik elektronları”,
değerlik elektronlarının bulunduğu orbitallere “değerlik orbitalleri” denir. Değerlik elektronları genellikle
en dış enerji düzeyindeki elektronlardır. B gruplarında, en dış enerji seviyesindeki s orbitallerinin yanı
sıra bir alt enerji düzeyindeki d orbitalleri de bağ yapımında etkin olduğu için değerlik elektronları olarak
düşünülür.
Burcu, değerlik elektronları ve değerlik orbitalleri ile ilgili kimya ödevi için bir oyun tasarlamıştır. Oyunun
amacı, her sütun için verilen özelliğe sahip elementi bulup doğru çıkışa ulaşabilmektir.
1. sütun: Değerlik elektron sayısı 5’tir.
2. sütun: Değerlik orbitallerinden birisinin açısal momentum kuantum sayısı l=2’dir.
3. sütun: Değerlik elektron sayısı en azdır.
4. sütun: Değerlik orbitallerinin tamamı yarı doludur.
5. sütun: Değerlik elektron sayısı ile değerlik orbitallerinin sayısı eşittir.
37