Page 80 - Kimya Sınıf İçi Değerlendirme
P. 80
KİMYA SINIF İÇİ DEĞERLENDİRME
SINIF İÇİ DEĞERLENDİRME ÖRNEĞİ 7
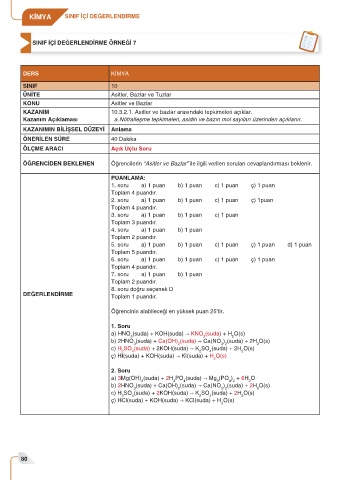
DERS KİMYA
SINIF 10
ÜNİTE Asitler, Bazlar ve Tuzlar
KONU Asitler ve Bazlar
KAZANIM 10.3.2.1. Asitler ve bazlar arasındaki tepkimeleri açıklar.
Kazanım Açıklaması a. Nötralleşme tepkimeleri, asidin ve bazın mol sayıları üzerinden açıklanır.
KAZANIMIN BİLİŞSEL DÜZEYİ Anlama
ÖNERİLEN SÜRE 40 Dakika
ÖLÇME ARACI Açık Uçlu Soru
ÖĞRENCİDEN BEKLENEN Öğrencilerin “Asitler ve Bazlar” ile ilgili verilen soruları cevaplandırması beklenir.
PUANLAMA:
1. soru a) 1 puan b) 1 puan c) 1 puan ç) 1 puan
Toplam 4 puandır.
2. soru a) 1 puan b) 1 puan c) 1 puan ç) 1puan
Toplam 4 puandır.
3. soru a) 1 puan b) 1 puan c) 1 puan
Toplam 3 puandır.
4. soru a) 1 puan b) 1 puan
Toplam 2 puandır.
5. soru a) 1 puan b) 1 puan c) 1 puan ç) 1 puan d) 1 puan
Toplam 5 puandır.
6. soru a) 1 puan b) 1 puan c) 1 puan ç) 1 puan
Toplam 4 puandır.
7. soru a) 1 puan b) 1 puan
Toplam 2 puandır.
8. soru doğru seçenek D
DEĞERLENDİRME Toplam 1 puandır.
Öğrencinin alabileceği en yüksek puan 25’tir.
1. Soru
a) HNO (suda) + KOH(suda) → KNO (suda) + H O(s)
3 3 2
b) 2HNO (suda) + Ca(OH) (suda) → Ca(NO ) (suda) + 2H O(s)
3 2 3 2 2
c) H SO (suda) + 2KOH(suda) → K SO (suda) + 2H O(s)
2 4 2 4 2
ç) HI(suda) + KOH(suda) → KI(suda) + H O(s)
2
2. Soru
a) 3Mg(OH) (suda) + 2H PO (suda) → Mg (PO ) + 6H O
2 3 4 3 4 2 2
b) 2HNO (suda) + Ca(OH) (suda) → Ca(NO ) (suda) + 2H O(s)
3 2 3 2 2
c) H SO (suda) + 2KOH(suda) → K SO (suda) + 2H O(s)
2 4 2 4 2
ç) HCl(suda) + KOH(suda) → KCl(suda) + H O(s)
2
80