Page 149 - 3 Adım AYT Kimya
P. 149
KİMYA
AYT 2.
Elektrokimyasal Hücreler - Elektrot ADIM
Potansiyelleri - Elektroliz - Korozyon - B
+
2+
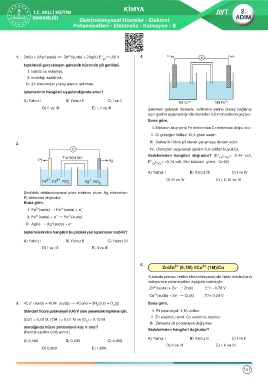
1. Zn(k) + 2Ag (suda) ø Zn (suda) + 2Ag(k) E° =1,56 V 4. Cr Fe(k)
pil
tepkimesi gerçekleşen galvanik hücrenin pil gerilimi,
I. katota su eklemek,
II. sıcaklığı azaltmak,
III. Zn elektrodun yüzey alanını artırmak
işlemlerinin hangileri uygulandığında artar?
A) Yalnız I B) Yalnız II C) I ve II 3+ 2+
1M Cr 1M Fe
D) II ve III E) I, II ve III Şekildeki galvanik hücrede, voltmetre yerine üreteç bağlanıp
aşırı gerilim uygulandığında devreden 0,6 mol elektron geçiyor.
Buna göre,
I. Elektron akış yönü Fe elektrottan Cr elektroda doğru olur.
II. Cr çubuğun kütlesi 10,4 gram azalır.
III. Galvanik hücre pil olarak çalışmaya devam eder.
2.
IV. Üreteçten uygulanan gerilim 0,3 volttan büyüktür.
ifadelerinden hangileri doğrudur? (E° 2+ = -0,44 volt,
Fe /Fe
E° 3+ = -0,74 volt, Mol kütleleri, g/mol, Cr:52)
Cr /Cr
A) Yalnız I B) Yalnız III C) I ve IV
D) III ve IV E) I, II, III ve IV
Şekildeki elektrokimyasal pilde elektron akımı Ag elektrottan
Pt elektroda doğrudur.
Buna göre,
3+
2+
I. Fe (suda) † Fe (suda) + e –
3+
2+
–
II. Fe (suda) + e † Fe (suda)
+
III. Ag(k) † Ag (suda) + e –
tepkimelerinden hangileri bu pildeki yarı tepkimeler olabilir?
A) Yalnız I B) Yalnız II C) Yalnız III
D) I ve III E) II ve III
5.
Yukarıda şeması verilen elektrokimyasal pile ilişkin elektrotların
indirgenme potansiyelleri aşağıda verilmiştir.
-
2+
Zn (suda) + 2e † Zn(k) E°= -0,76 V
2+
-
Cu (suda) + 2e † Cu(k) E°= 0,34 V
+
–
3. 4Cu (suda) + 4OH (suda) † 4Cu(k) + 2H O(s) + O (g) Buna göre,
2 2
Standart hücre potansiyeli 0,40 V olan yukarıdaki tepkime için, I. Pil potansiyeli 1,10 volttur.
II. Zn elektrotu anot, Cu elektrotu katottur.
–
+
[Cu ] = 0,10 M, [OH ] = 0,01 M ve [O ] = 0,10 M
2
III. Zamanla pil potansiyeli değişmez.
alındığında hücre potansiyeli kaç V olur?
(Nernst sabitini 0,06 alınız.) ifadelerinden hangileri doğrudur?
A) Yalnız I B) Yalnız II C) I ve II
A) 0,180 B) 0,235 C) 0,400
D) II ve III E) I, II ve III
D) 0,800 E) 1,650
147