Page 15 - KİMYA-11
P. 15
Ortaöğretim Genel Müdürlüğü KİMYA 11 5
1.ÜNİTE>Modern Atom Teorisi
Kazanım: 11.1.3.1. Periyodik özelliklerdeki değişim eğilimlerini sebepleriyle açıklar.
b. Periyodik özellikler arasında metallik/ametallik, atom/iyon yarıçapı, iyonlaşma enerjisi, elektron ilgisi, elektronegatiflik ve oksit/hidroksit
bileşiklerinin asitlik/bazlık eğilimleri üzerinde durulur.
Alan Becerileri: Çıkarım Yapma Becerisi Genel Beceriler: Eleştirel Düşünme Becerisi
Etkinlik İsmi ÇAPIN KADAR İLERLE 20 dk.
Amacı Periyodik özelliklerdeki değişimlerin atom yarıçapı ile ilişkisini açıklayabilme Bireysel
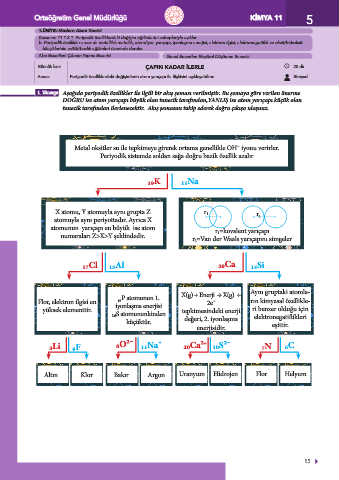
1. Yönerge Aşağıda periyodik özellikler ile ilgili bir akış şeması verilmiştir. Bu şemaya göre verilen önerme
DOĞRU ise atom yarıçapı büyük olan tanecik tarafından,YANLIŞ ise atom yarıçapı küçük olan
tanecik tarafından ilerlenecektir. Akış şemasını takip ederek doğru çıkışa ulaşınız.
Metal oksitler su ile tepkimeye girerek ortama genellikle OH¯ iyonu verirler.
Periyodik sistemde soldan sağa doğru bazik özellik azalır
₁₉K ₁₁Na
X atomu, Y atomuyla aynı grupta Z r 1
atomuyla aynı periyottadır. Ayrıca X r 2
atomunun yarıçapı en büyük ise atom r 1 =kovalent yarıçapı
numaraları Z>X>Y şeklindedir. r 2 =Van der Waals yarıçapını simgeler
₁₇Cl ₁₃Al ₂₀Ca ₁₄Si
rın kimyasal özellikle-
Flor, elektron ilgisi en 15 P atomunun 1. X(g) + Enerji → X(g) + Aynı gruptaki atomla-
2e¯
yüksek elementtir. iyonlaşma enerjisi tepkimesindeki enerji ri benzer olduğu için
₁₆S atomununkinden elektronegatiflikleri
küçüktür. değeri, 2. iyonlaşma eşittir.
enerjisidir.
₃Li ₉F ₈O²¯ ₁₁Na + ₂₀Ca² ₁₀S²¯ ₇N ₆C
+
Altın Klor Bakır Argon Uranyum Hidrojen Flor Helyum
15