Page 117 - Fizik 12 - Beceri Temelli Etkinlik Kitabı
P. 117
Ortaöğretim Genel Müdürlüğü FİZİK 12 72
4. ÜNİTE > Atom Fiziğine Giriş ve Radyoaktivite Kazanım 12.4.1.1: Atom kavramını açıklar.
b) Atom teorilerinin birbirleriyle ilişkili olarak geliştirildiği vurgulanmalıdır.
c) Bohr atom teorisinde; atom yarıçapı, enerji seviyeleri, uyarılma, iyonlaşma ve
ışıma kavramları vurgulanır. Matematiksel hesaplamalara girilmez.
Genel Beceriler: Eleştirel Düşünme Becerisi Alan Becerileri: Çıkarım Yapma Becerisi
Etkinlik İsmi GERÇEKTE NE OLUYOR? 20 dk.
Amacı Atom teorilerinin gelişimini birbirleri ile ilişkilendirerek Bohr atom teorisini açıklayabilme. Bireysel
1. Yönerge “Hidrojen Atomu Modelleri” adlı simülasyonu kullanabilmek için aşağıdaki basamakları uygula-
yınız.
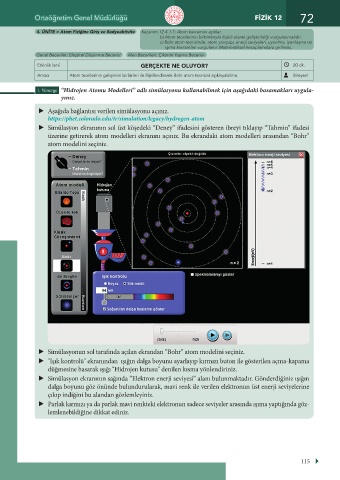
Aşağıda bağlantısı verilen simülasyonu açınız.
https://phet.colorado.edu/tr/simulation/legacy/hydrogen-atom
Simülasyon ekranının sol üst köşedeki “Deney” ifadesini gösteren ibreyi tıklayıp “Tahmin” ifadesi
üzerine getirerek atom modelleri ekranını açınız. Bu ekrandaki atom modelleri arasından “Bohr”
atom modelini seçiniz.
Simülasyonun sol tarafında açılan ekrandan “Bohr” atom modelini seçiniz.
"Işık kontrolü" ekranından ışığın dalga boyunu ayarlayıp kırmızı buton ile gösterilen açma-kapama
düğmesine basarak ışığı "Hidrojen kutusu" denilen kısma yönlendiriniz.
Simülasyon ekranının sağında “Elektron enerji seviyesi” alanı bulunmaktadır. Gönderdiğiniz ışığın
dalga boyunu göz önünde bulundurularak, mavi renk ile verilen elektronun üst enerji seviyelerine
çıkıp indiğini bu alandan gözlemleyiniz.
Parlak kırmızı ya da parlak mavi renkteki elektronun sadece seviyeler arasında ışıma yaptığında göz-
lemlenebildiğine dikkat ediniz.
115