Page 22 - Kimya - 12. Sınıf Beceri Temelli
P. 22
Ortaöğretim Genel Müdürlüğü KİMYA 12 8
1. ÜNİTE > Kimya ve Elektrik Kazanım 12.1.3.1. Redoks tepkimelerinin istemliliğini standart elektrot potansiyellerini kullanarak açıklar.
a. Standart yarı hücre indirgenme potansiyelleri, standart hidrojen yarı hücresi ile ilişkilendirilir.
b. Metallerin aktiflik sırası üzerinde durulur.
c. İki ayrı yarı hücre arasındaki istemli redoks tepkimesinin, standart indirgenme potansiyelleri ile ilişkilendi-
rilmesi sağlanır
Genel Beceriler: Bilgi Okuryazarlığı Becerisi, Eleştirel Düşünme Becerisi Alan Becerileri: Verileri Toplama, Yorumlama, Sonuç Çıkarma Becerisi
Etkinlik İsmi STANDART ELEKTROT POTANSİYELLERİ NE İŞE YARAR? 20 dk.
Amacı Redoks tepkimelerinin istemliliğini standart elektrot potansiyellerini kullanarak açıklayabilme Bireysel
Gerekli Materyaller Araştırma için internet erişimi olan herhangi bir elektronik cihaz ve genel ağ.
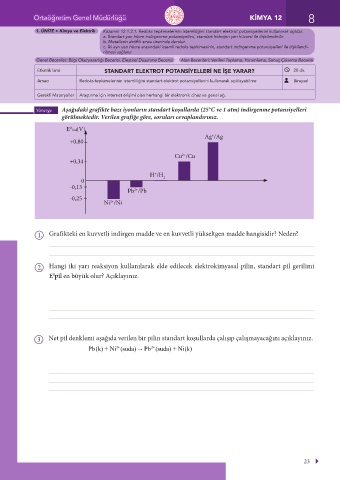
Yönerge Aşağıdaki grafikte bazı iyonların standart koşullarda (25°C ve 1 atm) indirgenme potansiyelleri
görülmektedir. Verilen grafiğe göre, soruları cevaplandırınız.
E ind(V)
0
Ag /Ag
+
+0,80
2+
Cu /Cu
+0,34
H /H
+
0 2
-0,13
Pb /Pb
2+
-0,25
Ni /Ni
2+
1. Grafikteki en kuvvetli indirgen madde ve en kuvvetli yükseltgen madde hangisidir? Neden?
2. Hangi iki yarı reaksiyon kullanılarak elde edilecek elektrokimyasal pilin, standart pil gerilimi
E pil en büyük olur? Açıklayınız.
0
3. Net pil denklemi aşağıda verilen bir pilin standart koşullarda çalışıp çalışmayacağını açıklayınız.
Pb(k) + Ni (suda) " Pb (suda) + Ni(k)
2+
2+
Ag(k) " Ag (suda) + e -
+
Ni(k) " Ni (suda) + 2e - E =+ 0,25V
0
2+
Ag (suda) + e " Ag(k) E =+ 0,80V
0
-
+
Ni(k) + 2Ag (suda) " Ni (suda) + 2Ag(k) Epil = 1,05V
0
2+
+
Pb(k) " Pb (suda) + 2e - E =+ 0,13V
0
2+
Ni + 2e (suda) " Ni(k) E =- 0,25V
0
2+
-
Pb(k) + Ni (suda) " Pb (suda) + Ni(k) Epil =- 0,12V
0
2+
2+
E Ag/Ag =- 1,05V
0
+
Ni 2 Pb 2 H2 2 Cu 2 Ag
23