Page 104 - Kimya 9 Beceri Temelli Etkinlik Kitabı
P. 104
Ortaöğretim Genel Müdürlüğü KİMYA 9 50
3. ÜNİTE > Kimyasal Türler Arası Etkileşimler Kazanım 9.3.3.3: Kovalent bağın oluşumunu atomlar arası elektron ortaklaşması temelinde
açıklar.
Genel Beceriler: Eleştirel Düşünme Alan Becerileri: Çıkarım Yapma, Sayı-Uzay İlişkileri Kurma
Etkinlik İsmi MOLEKÜL POLARLIĞI VE HİDROJEN BAĞI 30 dk.
Amacı Moleküllerin polarlık-apolarlık durumu ile zayıf etkileşimlerin fiziksel özellikleri arasında ilişki kurabilme. Bireysel
Gerekli Materyaller: Bilgisayar
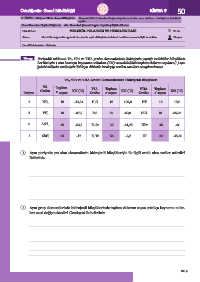
Yönerge Periyodik tablonun VA, VIA ve VIIA grubu elementlerinin hidrojenle yaptığı moleküler bileşiklerin
her biri için 1 atm basınçta kaynama noktaları (KN) ve moleküldeki toplam elektron sayıları (e ) aşa-
-
ğıdaki tabloda verilmiştir.Tabloyu dikkatle inceleyip verilen soruları cevaplandırınız.
VA, VIA ve VIIA Grubu Elementlerinin Hidrojenli Bileşikleri
VA Toplam o VIA Toplam o VIIA Toplam o
-
-
-
Periyot Grubu e sayısı KN ( C) Grubu e sayısı KN ( C) Grubu e sayısı KN ( C)
2 NH 3 10 -33,34 H O 10 100,0 HF 10 19,5
2
3 PH 3 18 -87,7 H S 18 -60,0 HCl 18 -85,05
2
4 AsH 3 36 -62,5 H Se 36 -41,25 HBr 36 -66
2
5 SbH 3 54 -17 H Te 54 -2,2 HI 54 -35,36
2
1. Aynı periyotta yer alan elementlerin hidrojenli bileşikleriyle ile ilgili ortak olan veriler nelerdir?
Belirtiniz.
2. Aynı grup elementlerinin hidrojenli bileşiklerinde toplam elektron sayısı arttıkça kaynama nokta-
ları nasıl değişmektedir? Gerekçesi ile belirtiniz.
103