Page 86 - Kimya 9 Beceri Temelli Etkinlik Kitabı
P. 86
Ortaöğretim Genel Müdürlüğü KİMYA 9 41
3. ÜNİTE > Kimyasal Türler Arası Etkileşimler Kazanım 9.3.3.1: İyonik bağın oluşumunu iyonlar arası etkileşimler ile ilişkilendirir.
Genel Beceriler: Eleştirel Düşünme Alan Becerileri: Çıkarım Yapma
Etkinlik İsmi KİMYASAL LABİRENT 20 dk.
Amacı İyonik bağın oluşumunu ve özelliklerini kavrayabilme. Bireysel
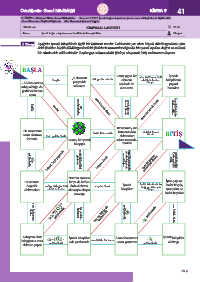
1. Yönerge Aşağıda iyonik bileşiklerle ilgili bir labirent vardır. Labirentte yer alan büyük dikdörtgenlerin için-
deki ifadeler küçük dikdörtgenlerdeki ifadelerle tamamlandığında kimyasal açıdan doğru ve anlamlı
bir cümle elde edilmektedir. Başlangıç noktasındaki ifadeyi okuyarak bitiş noktasına ulaşınız.
BAŞLA
Lewis yapısı bir İyonik
16 S elementi son katmanındaki
beştir. 6A grubundadır. element elektronlardan bileşiklerin
13 Al elementinin periyodik sembolü ve oluşur. yapısal
sahip olduğu de- tablonun elementin birimleri
ğerlik elektronu
sayısı
oktavlar kuralı denir. ifade edilir. formül birimle
8A
ondur.
üçtür.
oktet kuralı denir.
kuralı denir.
grubundadır.
son katman
Bir atomun, son
2 He atomunun katmanındaki
Lewis elektron birim hücresidir. elektronları dublet kuralı BİTİŞ
denir.
formülü He şeklindedir Resim, bir iyonik sekize tamamla-
bileşiğin masına
kristal örgü yapısıdır. gösterir molekül şeklini katyon denir. arası oluşur ametal anyonu metal katyonuyla aynı iki iyonun olur. kadar güçlü iyonik bağ o
çekimiyle oluşur.
He
şeklindedir.
Nötr bir atomun
Bir atomun bir ya da birden İyon çapı ne
değerlik sahip olduğu tüm fazla elektron anyon denir. İyonik farklı iki ametalin kadar küçük,
bağ yapmasıyla
elektronları elektronlardır. almasıyla oluşan bileşikler oluşur. iyon yükü ne
taneciğe kadar büyükse
2[ O ] 2-
2+ şeklindedir. bulunur. katı hâlde her üç hâlde de şeklindedir. N şeklindedir. sıvı hâlde iletir.
2Ca bulunabilir. N
dadır.
son katmanın-
Kalsiyum oksit Ca [ O ] 2- İyonik bileşikler Azot elementinin İyonik bileşikler
N
2+
bileşiğinin Lewis şeklindedir oda şartlarında sıvı hâlde bulunur. Lewis gösterimi şeklindedir. elektriği
elektron yapısı
85