Page 21 - Kimya 10 | Çalışma Defteri 3
P. 21
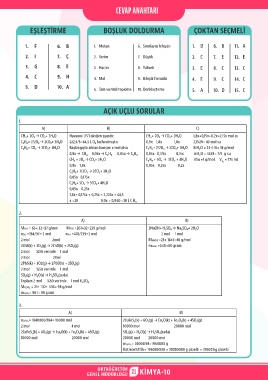
CEVAP ANAHTARI
EŞLEŞTİRME BOŞLUK DOLDURMA ÇOKTAN SEÇMELİ
1. F 6. B 1. Metan 6. Sınırlayıcı bileşen 1. D 6. B 11. A
2. I 7. Ç 2. Verim 7. Düşük 2. C 7. E 12. E
3. G 8. E 3. Hacim 8. Yüksek 3. E 8. C 13. C
4. C 9. H 4. Mol 9. Bileşik formülü 4. E 9. C 14. C
5. D 10. A
5. Tam verimli tepkime 10. Denkleştirme 5. A 10. D 15. C
AÇIK UÇLU SORULAR
1.
A) B) C)
CH₄+ 2O₂ → CO₂+ 2H₂O Havanın 1/5’i oksijen gazıdır. CH₄+ 2O₂ → CO₂+ 2H₂O 1,8x+0,15x+0,2x=2,15x mol su
C₂H₆+ 7/2O₂ → 2CO₂+ 3H₂O 222,5/5=44,5 L O₂ kullanılmıştır. 0,9x 1,8x 1,8x 2,15·20= 43 mol su
C₃H₈+ 5O₂ → 3CO₂+ 4H₂O Başlangıçta alınan karışım x mol olsa C₂H₆+ 7/2O₂ → 2CO₂+ 3H₂O MH₂O = 2·1+1·16= 18 g/mol
0,9x → CH₄ 0,05x → C₂H₆ 0,05x → C₃H₈ 0,05x 0,175x 0,15x mH₂O = 43.18= 774 g su
CH₄ + 2O₂ → CO₂+ 2H₂O C₃H₈ + 5O₂ → 3CO₂ + 4H₂O dSu =1 g/moL V = 774 mL
Su
0,9x 1,8x 0,05x 0,25x 0,2x
C₂H₆+ 7/2O₂ → 2CO₂+ 3H₂O
0,05x 0,175x
C₃H₈+ 5O₂ → 3CO₂+ 4H₂O
0,05x 0,25x
1,8x+ 0,175x + 0,25x = 2,225x = 44,5
x =20 0,9x = 0,9·20 =18 L C H₄
2.
A) B)
MZnS = 65+ 32=97 g/mol MPbS =207+32=239 g/mol 2NaOH+ H₂SO₄ → Na₂SO₄+ 2H₂O
nZnS =194/97= 2 mol nPbS =478/239=2 mol 2 mol 1 mol
2 mol 2mol MNaOH =23+ 16+1=40 g/mol
2ZnS(k) + 3O₂(g) → 2ZnO(k) + 2SO₂(g) mNaOH =2·40=80 gram
2 mol %50 verimle 1 mol
2 mol 2mol
2PbS(k) + 3O2(g) → 2PbO(k) + 2SO₂(g)
2 mol %50 verimle 1 mol
SO₂(g) + H₂O(s) → H₂SO₄(suda)
Toplam 2 mol %50 verimle 1 mol H₂SO₄
MH₂SO₄ = 2·1+ 1·32+ 4·16= 98 g/mol
mH₂SO₄= 98·1= 98 gram
3.
A) B)
nCuFeS₂= 1840000/184= 10000 mol 2CuFeS₂(k) + 6O₂(g) → Cu₂O(k) + Fe₂O₃(k) + 4SO₂(g)
2 mol 4 mol 10000 mol 20000 mol
2CuFeS (k) + 6O₂(g) → Cu₂O(k) + Fe₂O₃(k) + 4SO₂(g) SO₂(g) + H₂O(s) → H₂SO₄(suda)
2
10000 mol 20000 mol 20000 mol 20000 mol
mH₂SO₄ = 20000·98=1960000 g
Kütlece%5’lik= 1960000·20 = 39200000 g çözelti = 39200 kg çözelti
MATEMATİK-11
ORTAÖĞRETİM 21 KİMYA-10
GENEL MÜDÜRLÜĞÜ