Page 101 - Defterim Kimya - 9
P. 101
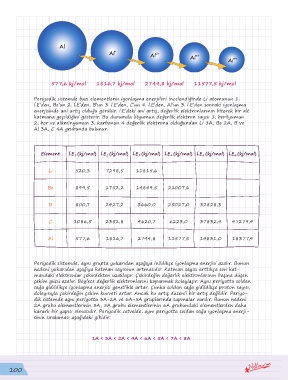
Al
Al + 2+
Al Al 3+
Al 4+
577,6 kj/mol 1816,7 kj/mol 2744,8 kj/mol 11577,5 kj/mol
Periyodik sistemde bazı elementlerin iyonlaşma enerjileri incelendiğinde Li atomunun 1.
İ.E’den, Be’un 2. İ.E’den, B’un 3. İ.E’den, C’un 4. İ.E’den, Al’un 3. İ.E’den sonraki iyonlaşma
enerjisinde ani artış olduğu görülür. İ.E’deki ani artış, değerlik elektronlarının biterek bir alt
katmana geçildiğini gösterir. Bu durumda lityumun değerlik elektron sayısı 1, berilyumun
2, bor ve alüminyumun 3, karbonun 4 değerlik elektronu olduğundan Li 1A, Be 2A, B ve
Al 3A, C 4A grubunda bulunur.
Element İ.E (kj/mol) İ.E (kj/mol) İ.E (kj/mol) İ.E (kj/mol) İ.E (kj/mol) İ.E (kj/mol)
3
2
1
5
6
4
Li 520,3 7298,5 11815,6
Be 899,5 1752,2 14849,5 21007,6
B 800,7 2427,2 3660,0 25027,0 32828,3
C 1086,5 2352,8 4620,7 6223,0 37832,4 47279,4
Al 577,6 1816,7 2744,8 11577,5 14831,0 18377,9
Periyodik sistemde, aynı grupta yukarıdan aşağıya inildikçe iyonlaşma enerjisi azalır. Bunun
nedeni yukarıdan aşağıya katman sayısının artmasıdır. Katman sayısı arttıkça son kat-
mandaki elektronlar çekirdekten uzaklaşır. Çekirdeğin değerlik elektronlarının başına düşen
çekim gücü azalır. Böylece değerlik elektronlarını koparmak kolaylaşır. Aynı periyotta soldan
sağa gidildikçe iyonlaşma enerjisi genellikle artar. Çünkü soldan sağa gidildikçe proton sayısı,
dolayısıyla çekirdeğin çekim kuvveti artar. Ancak bu artış düzenli bir artış değildir. Periyo-
dik sistemde aynı periyotta 3A-2A ve 6A-5A gruplarında sapmalar vardır. Bunun nedeni
2A grubu elementlerinin 3A, 5A grubu elementlerinin 6A grubundaki elementlerden daha
kararlı bir yapısı olmasıdır. Periyodik cetvelde, aynı periyotta soldan sağa iyonlaşma enerji-
sinin sıralaması aşağıdaki gibidir:
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
Notlarım
Notlarım
100