Page 145 - Defterim Kimya - 9
P. 145
Notlarım
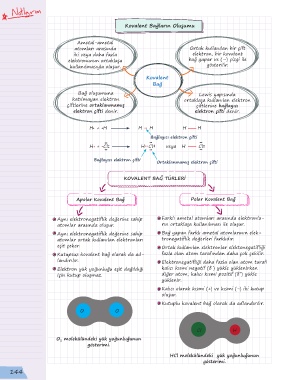
Kovalent Bağların Oluşumu
Ametal-ametal
atomları arasında Ortak kullanılan bir çift
iki veya daha fazla elektron, bir kovalent
elektronunun ortaklaşa bağ yapar ve (–) çizgi ile
kullanılmasıyla oluşur. gösterilir.
Kovalent
Bağ
Bağ oluşumuna Lewis yapısında
katılmayan elektron ortaklaşa kullanılan elektron
çiftlerine ortaklanmamış çiftlerine bağlayıcı
elektron çifti denir. elektron çifti denir.
H + H H H H H
Bağlayıcı elektron çifti
H + Cl H Cl veya H Cl
Bağlayıcı elektron çifti
Ortaklanmamış elektron çifti
KOVALENT BAĞ TÜRLERİ
Apolar Kovalent Bağ Polar Kovalent Bağ
Aynı elektronegatiflik değerine sahip Farklı ametal atomları arasında elektronla-
atomlar arasında oluşur. rın ortaklaşa kullanılması ile oluşur.
Aynı elektronegatiflik değerine sahip Bağ yapan farklı ametal atomlarının elek-
atomlar ortak kullanılan elektronları tronegatiflik değerleri farklıdır.
eşit çeker. Ortak kullanılan elektronlar elektonegatifliği
Kutupsuz kovalent bağ olarak da ad- fazla olan atom tarafından daha çok çekilir.
landırılır. Elektronegatifliği daha fazla olan atom tarafı
-
Elektron yük yoğunluğu eşit dağıldığı kalıcı kısmi negatif (δ ) yükle yüklenirken
+
için kutup oluşmaz. diğer atom, kalıcı kısmi pozitif (δ ) yükle
yüklenir.
Kalıcı olarak kısmi (+) ve kısmi (-) iki kutup
oluşur.
Kutuplu kovalent bağ olarak da adlandırılır.
O O
Cl H
molekülündeki yük yoğunluğunun
O 2
gösterimi.
HCl molekülündeki yük yoğunluğunun
gösterimi.
144