Page 170 - Defterim Kimya - 9
P. 170
Notlarım
Maddedeki Değişimler
Fiziksel Değişim Kimyasal Değişim
Maddenin kimlik özelliği değişmeden Maddenin kimlik özelliğinin değişerek,
boyutu, şekli, fiziksel hâli (katı, sıvı, gaz) farklı maddelere ayrışması veya farklı
ve fiziksel özelliklerinin değişmesidir. maddelerle etkileşip yeni maddeleri
oluşturmasıdır.
Fiziksel değişimde
Kimyasal değişimde
• Maddenin kimyasal yapısı değişmez.
• Maddenin iç yapısı (elektron düzeni
• Maddenin formülü değişmez.
ve bağ yapısı) değişir.
• Zayıf etkileşimler kopar veya oluşur.
• Maddenin hem kimyasal hem de
• Kopan veya oluşan bağın enerjisi fiziksel özellikleri değişir.
genellikle 40 kj/mol’den küçüktür.
• Maddenin kimyasal formülü değişir.
• Güçlü ve zayıf etkileşimler kopar
veya oluşur.
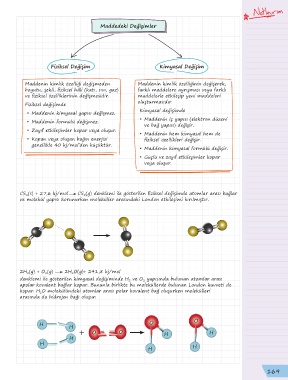
CS (s) + 27,6 kj/mol CS (g) denklemi ile gösterilen fiziksel değişimde atomlar arası bağlar
2
2
ve molekül yapısı korunurken moleküller arasındaki London etkileşimi kırılmıştır.
2H (g) + O (g) 2H O(g)+ 241,8 kj/mol
2
2
2
denklemi ile gösterilen kimyasal değişiminde H ve O yapısında bulunan atomlar arası
2
2
apolar kovalent bağlar kopar. Bununla birlikte bu moleküllerde bulunan London kuvveti de
kopar. H O molekülündeki atomlar arası polar kovalent bağ oluşurken molekülleri
2
arasında da hidrojen bağı oluşur.
O
H O
H
+ O O H H
H
H
H H
169