Page 274 - Defterim Kimya - 9
P. 274
B) 12. çıkış
C) 1. E 2. E 3. D 4. E 5. B 6. C 7. B 8. A 9. E 10. A 11. C 12. C
13. B 14. A 15. A 16. D 17. E 18. E 19. A 20. E 21. C 22. D
KONTROL NOKTASI s. 112
A) 1. Thomson atom modelinde elektron adı verilen negatif (-) yüklü tanecikler, pozitif yüklü atomun içinde
homojen olarak dağılmıştır. Rutherford atom modelinde ise pozitif yükün tümü, çekirdek denilen
küçük bölgede toplanmıştır.
2. IV ile verilen Bohr atom modeli ile ilişkilidir. Çekirdek etrafındaki elektronların uzaklığından bahseden
ilk modeldir.
3. a) Aldıkları ısı enerjisi sayesinde elektronlar, üst enerji seviyesine çıkar ve temel hâle dönerken aldığı
enerjiyi farklı renkte ışık olarak geri verir. Her atom enerji farklı olduğu için renk karakteristiktir.
b) Bohr atom modeli ile açıklanır. Bohr atom modeli tek elektronlu atom ve iyonların davranışınlarını
açıklarken çok elektronlularda yetersiz kalmıştır.
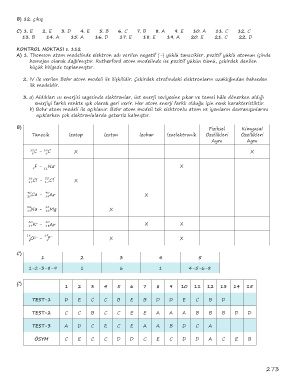
B) Fiziksel Kimyasal
Tanecik İzotop İzoton İzobar İzoelektronik Özellikleri Özellikleri
Aynı Aynı
12 C - C
14
6 6 X X
F - Na + X
9 11
36 Cl - 35 Cl -
17 17 X
40 40
20 Ca - 18 Ar X
23 24
11 Na - 12 Mg X
40 40
19 K - 18Ar X X
+
18 19 -
2-
O - F X X
8 9
C)
1 2 3 4 5
1-2-3-8-9 1 6 1 4-5-6-8
Ç)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
TEST-1 D E C C B E B D D E C B D
TEST-2 C C B C C E E A A A B B B D D
TEST-3 A D C E C E A A B D C A
ÖSYM C E C C D D C E C D D A C E B
273