Page 106 - Konu Özetleri AYT Kimya
P. 106
LEWIS FORMÜLLERI - HIBRITLEŞME - MOLEKÜL GEOMETRILERI
HIBRITLEŞME - MOLEKÜL GEOMETRILERI
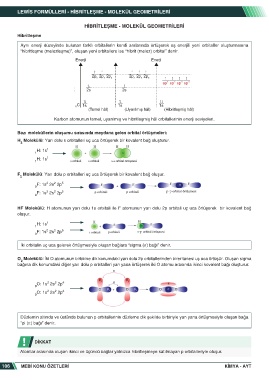
Hibritleşme
Aynı enerji düzeyinde bulunan farklı orbitallerin kendi aralarında örtüşerek eş enerjili yeni orbitaller oluşturmasına
“hibritleşme (melezleşme)”, oluşan yeni orbitallere ise “hibrit (melez) orbital” denir.
Karbon atomunun temel, uyarılmış ve hibritleşmiş hâl orbitallerinin enerji seviyeleri.
Bazı moleküllerin oluşumu sırasında meydana gelen orbital örtüşmeleri:
H Molekülü: Yarı dolu s orbitalleri uç uca örtüşerek bir kovalent bağ oluşturur.
2
H: 1s 1
1
H: 1s 1
1
F Molekülü: Yarı dolu p orbitalleri uç uca örtüşerek bir kovalent bağ oluşur.
2
2
2
F: 1s 2s 2p 5
9
2
2
F: 1s 2s 2p 5
9
HF Molekülü: H atomunun yarı dolu 1s orbitali ile F atomunun yarı dolu 2p orbitali uç uca örtüşerek bir kovalent bağ
oluşur.
H: 1s 1
1
2
2
F: 1s 2s 2p 5
9
İki orbitalin uç uca gelerek örtüşmesiyle oluşan bağlara “sigma (σ) bağı” denir.
O Molekülü: İki O atomunun birbirine dik konumdaki yarı dolu 2p orbitallerinden birer tanesi uç uca örtüşür. Oluşan sigma
2
bağına dik konumdaki diğer yarı dolu p orbitalleri yan yana örtüşerek iki O atomu arasında ikinci kovalent bağı oluşturur.
2
2
O: 1s 2s 2p 4
8
2
2
O: 1s 2s 2p 4
8
Düzlemin altında ve üstünde bulunan p orbitallerinin düzleme dik şekilde birbiriyle yan yana örtüşmesiyle oluşan bağa
“pi (π) bağı” denir.
DIKKAT
Atomlar arasında oluşan ikinci ve üçüncü bağlar yalnızca hibritleşmeye katılmayan p orbitalleriyle oluşur.
106 MEBİ KONU ÖZETLERİ KIMYA - AYT