Page 46 - Kimya - 10 Beceri Temelli Etkinlik Kitabı
P. 46
Ortaöğretim Genel Müdürlüğü KİMYA 10 22
2. ÜNİTE > Karışımlar Kazanım 10.2.1.4. Çözeltilerin özelliklerini günlük hayattan örneklerle açıklar.
Genel Beceriler: Bilgi Okuryazarlığı Becerisi Alan Becerileri: Çıkarım Yapma Becerisi
Etkinlik İsmi DİKKAT! KAYGAN ZEMİN 20 dk.
Amacı Kara yollarında buzlanmaya karşı alınan önlemler ve bu önlemlerin olumlu-olumsuz etkilerini açıklayabilme Bireysel
Yönerge Koligatif özelliklerle ilgili verilen bilgileri okuyunuz ve tablodan yararlanarak aşağıdaki soruları
cevaplayınız.
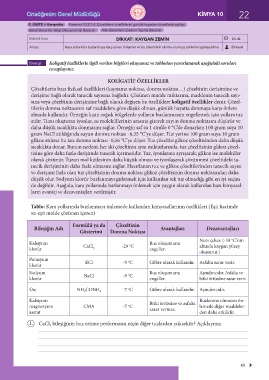
KOLİGATİF ÖZELLİKLER
Çözeltilerin bazı fiziksel özellikleri (kaynama noktası, donma noktası…) çözeltinin derişimine ve
derişime bağlı olarak tanecik sayısına bağlıdır. Çözünen madde miktarına, maddenin tanecik sayı-
sına veya çözeltinin derişimine bağlı olarak değişen bu özelliklere koligatif özellikler denir. Çözel-
tilerin donma noktasının saf maddelere göre düşük olması, günlük hayatta donmaya karşı önlem
almada kullanılır. Örneğin kışın soğuk bölgelerde yolların buzlanmasını engellemek için yollara tuz
atılır. Tuzu oluşturan iyonlar, su moleküllerinin arasına girerek suyun donma noktasını düşürür ve
daha düşük sıcaklıkta donmasını sağlar. Örneğin saf su 1 atm’de 0 °C’de donarken 100 gram suya 10
gram NaCI atıldığında suyun donma noktası -6,35 °C’ye düşer. Tuz yerine 100 gram suya 10 gram
glikoz atılırsa bu kez donma noktası -0,56 °C’ye düşer. Tuz çözeltisi glikoz çözeltisinden daha düşük
sıcaklıkta donar. Bunun nedeni, her iki çözeltinin aynı miktarlarında, tuz çözeltisinin glikoz çözel-
tisine göre daha fazla derişimde tanecik içermesidir. Tuz, iyonlarına ayrışarak; glikoz ise moleküler
olarak çözünür. Tuzun mol kütlesinin daha küçük olması ve iyonlaşarak çözünmesi çözeltideki ta-
necik derişiminin daha fazla olmasını sağlar. Hazırlanan tuz ve glikoz çözeltilerinden tanecik sayısı
ve derişimi fazla olan tuz çözeltisinin donma noktası glikoz çözeltisinin donma noktasından daha
düşük olur. Sodyum klorür buzlanmayı gidermek için kullanılan tek tuz olmadığı gibi en iyi seçim
de değildir. Aşağıda, kara yollarında buzlanmayı önlemek için yaygın olarak kullanılan bazı kimyasal-
ların avantaj ve dezavantajları verilmiştir.
Tablo: Kara yollarında buzlanmayı önlemede kullanılan kimyasallarının özellikleri (Eşit hacimde
su-eşit molde çözünen içeren)
Formülü ya da Çözeltinin
Bileşiğin Adı Avantajları Dezavantajları
Gösterimi Donma Noktası
Nem çeker. (-18 C’nin
o
Kalsiyum CaCl -29 C Buz oluşumunu altında kaygan yüzey
o
klorür 2 engeller.
oluşturur.)
Potasyum KCl -9 C Gübre olarak kullanılır. Asfalta zarar verir.
o
klorür
Sodyum NaCl -9 C Buz oluşumunu Aşındırıcıdır. Asfalta ve
o
klorür engeller. bitki örtüsüne zarar verir.
Üre NH 2CONH 2 -7 C Gübre olarak kullanılır. Aşındırıcıdır.
o
Kalsiyum Bitki örtüsüne ve asfalta Buzlanma olmasını ön-
magnezyum CMA -7 C zarar vermez. lemede diğer maddeler-
o
asetat den daha etkilidir.
1. CaCl 2 bileşiğinin buz eritme performansı niçin diğer tuzlardan yüksektir? Açıklayınız.
45