Page 160 - Kimya 9 Beceri Temelli Etkinlik Kitabı
P. 160
Ortaöğretim Genel Müdürlüğü KİMYA 9 78
4. ÜNİTE > Maddenin Hâlleri Kazanım 9.4.2.1: Katıların özellikleri ile bağların gücü arasında ilişki kurar.
Genel Beceriler: Eleştirel Düşünme, Yaratıcı Düşünme Alan Becerileri: Verileri Toplama, İşleme, Yorumlama, Sonuç Çıkarma
Etkinlik İsmi KATILARIN ÖZELLİKLERİ 20 dk.
Amacı Katıların özellikleri ile bağların gücü arasında ilişkiyi yorumlayabilme. Bireysel
1. Yönerge Katılarla ilgili verilen bilgileri okuyunuz ve bu bilgilerden yararlanarak soruları yanıtlayınız.
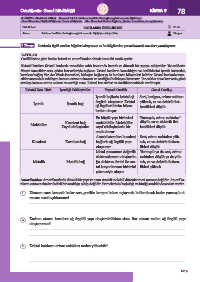
KATILAR
Özelliklerine göre katılar kristal ve amorf katılar olmak üzere iki sınıfa ayrılır.
Kristal katılar: Kristal katılarda tanecikler sabit konumda kararlı ve düzenli bir yapıya sahiptirler. Taneciklerin
düzeni tanecikler arası çekim kuvvetleriyle sağlanır. Kristal katıların kararlılığını ve özelliklerini iyonik kuvvetler,
kovalent bağlar, Van der Waals kuvvetleri, hidrojen bağları ya da bunların bileşimleri belirler. Kristal katılarda tane-
cikler arasındaki etkileşim katının erime noktasını ve sertliğini belirleyen kuvvettir. Tanecikler arası kuvvetin gücü
arttıkça katının erime noktası ve sertliği artar. Kristal katı türleri ve özellikleri tabloda verilmiştir.
Kristal Katı Türü İçerdiği Etkileşimler Yapısal Özellik Genel Özellik
İyonik bağlarla kristal ağ Sert, kırılgan, erime noktası
örgüsü oluşturur. Kristal yüksek, ısı ve elektrik ilet-
İyonik İyonik bağ
ağ örgüleri birim hücre- kenlikleri düşük
lerden oluşur.
En küçük yapı birimleri Yumuşak, erime noktaları
Kovalent bağ moleküldür. Moleküller düşük, ısı ve elektrik ilet-
Moleküler
Zayıf etkileşimler zayıf etkileşimlerle bir kenlikleri düşük
arada durur.
Ametal atomları kovalent Sert, erime noktaları yük-
Kovalent Kovalent bağ bağlarla ağ örgülü yapı sek, ısı ve elektrik iletken-
oluşturur. likleri düşük
Metal atomunun değerlik Yumuşak ya da sert, erime
elektronlarının oluşturdu- noktaları düşük ya da yük-
Metalik Metalik bağ ğu elektron denizi ile me- sek, ısı ve elektrik iletken-
tal katyonlarının birbirini likleri yüksek
çekmesiyle oluşur.
Amorf katılar: Amorf katılarda düzenli bir yapı ve uzun zincirli molekül düzenlenmesi mevcut değildir. Amorf ka-
tıların erime noktaları belirli bir sıcaklığa sahip değildir. Erimelerinin başladığı ve bittiği sıcaklık dereceleri vardır.
1. Elmasın camı kesecek kadar sert, grafitin kurşun kalem uçlarında kullanılacak kadar yumuşak ol-
masını nasıl açıklarsınız?
2. Karbon atomu kovalent ağ örgülü yapı oluşturabilirken sizce flor atomu neden ağ örgülü yapı
oluşturamaz?
3. Kristal katıların erime noktaları neden yüksektir?
159