Page 22 - Fen Lisesi Kimya 9 | 2. Ünite
P. 22
c) Atomların Katman Elektron Dağılımı ve Grup-Periyot İlişkisi
Periyodik tabloda aynı grupta yer alan elementlerin özellikleri neden
birbirine benzemektedir? Bu soruya cevap verebilmek için elementlerin
katman elektron dağılımını incelemek gerekir. Nobel Kimya ödüllü Li-
nus Pauling (Linus Poling) tarafından önerilen “katman elektron modeli”
atomların davranışlarını açıklayan ilk çalışmadır. Katman elektron dağı-
lımı bir atomun görünümünü açıklayan bir model değildir. Atomun göz-
lenebilen bazı davranışlarını açıklayan bir modeldir. Bu katman modeli
Bohr atom modelindeki yörüngelerle benzerlik göstermektedir.
Katman elektron dağılımı, atomların kimyasal özellikleri hakkında bil-
gi verir. Katman elektron dağılımı modelinde elektron çekirdek etrafın-
da bulunan katmanlara sırası ile yerleştirilir. Bu katmanların her birinin
çekirdeğe uzaklığına göre bir enerjisi vardır. Bu enerji seviyelerinin her
birine katman adı verilir. Katman elektron dağılımında
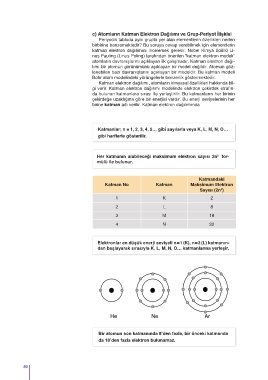
Katmanlar; n = 1, 2, 3, 4, 5… gibi sayılarla veya K, L, M, N, O…
gibi harflerle gösterilir.
2
Her katmanın alabileceği maksimum elektron sayısı 2n for-
mülü ile bulunur.
Katmandaki
Katman No Katman Maksimum Elektron
2
Sayısı (2n )
1 K 2
2 L 8
3 M 18
4 N 32
Elektronlar en düşük enerji seviyeli n = 1 (K), n = 2 (L) katmanın-
dan başlayarak sırasıyla K, L, M, N, O… katmanlarına yerleşir.
Bir atomun son katmanında 8’den fazla, bir önceki katmanda
da 18’den fazla elektron bulunamaz.
80 81