Page 10 - Kimya 11 | 2.Ünite
P. 10
Gazlar
CHARLES YASASI (Hacim-Sıcaklık İlişkisi)
İnsanoğlu var olduğu günden beri kuşlar gibi gökyüzünde uçmayı arzulamış, bu amaçla değişik yöntem-
ler denemiştir. Bu yöntemlerden biri de sıcak hava balonlarının kullanımıdır.
Sıcak havanın soğuk havadan daha hafif olmasından yararlanılarak sıcak hava balonu icat edilmiştir.
Sıcak hava balonundan ilham alan Fransız fizikçi Jocques Charles (Jök Şarl) 1787 yılında gazların hac-
miyle sıcaklığı arasındaki ilişkiyi açıklayabilmek için çeşitli deneyler yapmıştır (Görsel 2.1.5).
Charles Yasası, gazların sıcaklıkla nasıl genleştiğini gösteren gaz yasasıdır. Yasa, bir miktar gazın sabit
basınç altında tutulması durumunda, Kelvin cinsinden ölçülen sıcaklık ve hacim arasındaki bağıntıyı açıklar.
Görsel 2.1.5: Gazların hacim-sıcaklık ilişkisi
Hareketli pistonlu bir kapta bulunan gazın sıcaklığı artırıldığında gaz molekülleri daha hızlı hareket ede-
rek birbiriyle ve kabın yüzeyiyle daha sık ve daha kuvvetli çarpışır. Çarpışmanın etkisiyle piston yukarı doğ-
ru hareket eder ve kabın hacmi artar.
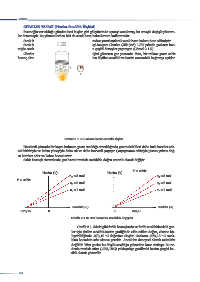
Sabit basınçlı sistemlerde gaz hacmi mutlak sıcaklıkla doğru orantılı olarak değişir.
P = sabit
Hacim (V) Hacim (V)
n =3 mol n =3 mol
3
3
P = sabit
n =2 mol n =2 mol
2
2
n =1 mol n =1 mol
1
1
o
o
Sıcaklık ( C) Sıcaklık ( K)
-273,15 0 0 273,15
Grafik 2.1.2: Gaz hacminin sıcaklıkla değişimi
Grafik 2.1.2ʼdeki gibi farklı basınçlarda ve farklı sıcaklıklardaki gaz-
lar için çizilen sıcaklık-hacim grafiğinde elde edilen doğru, eksene bir-
o o
leştirildiğinde -273,15 C değerine ulaşılır. Gazların -273,15 C sıcak-
lıkta hacminin sıfır olması gerekir. Ancak bu deneysel olarak mümkün
değildir. Tüm gazlar bu düşük sıcaklığa gelmeden önce sıvılaşır. Bu ne-
o
denle mutlak sıfıra (-273,15 C) yaklaştıkça grafikteki hacim çizgisi ke-
sikli olarak gösterilir
84