Page 21 - Kimya 9 | 2. Ünite
P. 21
KAZANIM 9.2.3.1
Atom ve Periyodik Sistem
Neler Kazanılacak? Elementlerin periyodik sistemdeki yerleşim esasları açıklanırken
a) Mendeleyev’in periyodik sistem üzerine yaptığı çalışmalar ve Moseley’in katkıları,
b) Atomların katman-elektron dağılımlarıyla periyodik sistemdeki yerleri arasındaki ilişki (İlk 20 ele-
ment esastır) kavranılacaktır.
2.3.1. ELEMENTLERİN PERİYODİK SİSTEMDEKİ
YERLEŞİM ESASLARI
Günümüzde 118 element olduğu bilinmektedir. Bu elementlerin
özelliklerini tek tek öğrenmek yerine elementleri gruplandırarak bu
grupların özelliklerini öğrenmek daha kolaydır. Birçok bilim insanı
da bu şekilde düşünerek elementleri çeşitli özelliklerine göre sınıf-
landırmaya çalışmıştır.
Günümüzdeki periyodik tabloya en yakın sınıflandırma 1869 yı-
lında Julius Lothar Mayer (Julis Lother Mayer) ve Dimitri Mendele-
yev’in (Dimitri Mendeleyev) çalışmalarına dayanmaktadır.
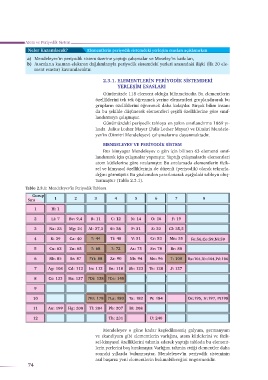
MENDELEYEV VE PERİYODİK SİSTEM
Rus kimyager Mendeleyev o gün için bilinen 63 elementi sınıf-
landırmak için çalışmalar yapmıştır. Yaptığı çalışmalarda elementleri
atom kütlelerine göre sıralamıştır. Bu sıralamada elementlerin fizik-
sel ve kimyasal özelliklerinin de düzenli (periyodik) olarak tekrarla-
dığını görmüştür. Bu gözlemden yararlanarak aşağıdaki tabloyu oluş-
turmuştur (Tablo 2.3.1).
Tablo 2.3.1: Mendeleyev’in Periyodik Tablosu
Gurup
Sıra 1 2 3 4 5 6 7 8
1 H: 1
2 Li: 7 Be: 9,4 B: 11 C: 12 N: 14 O: 16 F: 19
3 Na: 23 Mg: 24 Al: 27,3 Si: 28 P: 31 S: 32 Cl: 35,5
4 K: 39 Ca: 40 ?: 44 Ti: 48 V: 51 Cr: 52 Mn: 55 Fe:56,Co:59,Ni:59
5 Cu: 63 Zn: 65 ?: 68 ?: 72 As: 75 Se: 78 Br: 80
6 Rb: 85 Sr: 87 ?Yt: 88 Zr: 90 Nb: 94 Mo: 96 ?: 100 Ru:104,Rh:104,Pd:106
7 Ag: 108 Cd: 112 In: 113 Sn: 118 Sb: 122 Te: 128 J: 127
8 Cs: 133 Ba: 137 ?Di: 138 ?Ce: 140 Mendeleyev’in periyodik tablosu
9
10 ?Er: 178 ?La: 180 Ta: 182 W: 184 Os:195, Ir:197, Pt198
11 Au: 199 Hg: 200 Tl: 204 Pb: 207 Bi: 208
12 Th: 231 U: 240
Mendeleyev o güne kadar keşfedilmemiş galyum, germanyum
ve skandiyum gibi elementlerin varlığını, atom kütlelerini ve fizik-
sel-kimyasal özelliklerini tahmin ederek yaptığı tabloda bu element-
lerin yerlerini boş bırakmıştır. Varlığını tahmin ettiği elementler daha
sonraki yıllarda bulunmuştur. Mendeleyev’in periyodik sisteminin
asıl başarısı yeni elementlerin bulunabileceğini öngörmesidir.
74