Page 38 - Konu Özetleri TYT Kimya
P. 38
GÜÇLÜ ETKILEŞIMLER
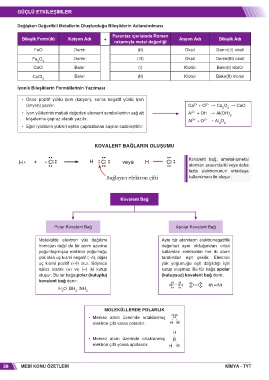
Değişken Değerlikli Metallerin Oluşturduğu Bileşiklerin Adlandırılması
Parantez içerisinde Romen
Bileşik Formülü Katyon Adı + Anyon Adı Bileşik Adı
rakamıyla metal değerliği
FeO Demir (II) Oksit Demir(II) oksit
Fe O Demir (III) Oksit Demir(III) oksit
2 3
CuCl Bakır (I) Klorür Bakır(I) klorür
CuCl Bakır (II) Klorür Bakır(II) klorür
2
Iyonik Bileşiklerin Formüllerinin Yazılması
• Önce pozitif yüklü iyon (katyon), sonra negatif yüklü iyon
2+
2�
(anyon) yazılır. Ca + O † Ca O † CaO
2 2
3+
�
• İyon yüklerinin mutlak değerleri element sembollerinin sağ alt Al + OH † Al(OH) 3
köşelerine çapraz olarak yazılır. Al + O † Al O
2�
3+
3 2
• Eğer iyonların yükleri eşitse çaprazlanan sayılar sadeleştirilir.
KOVALENT BAĞLARIN OLUŞUMU
Kovalent bağ, ametal-ametal
atomları arasında iki veya daha
fazla elektronunun ortaklaşa
kullanılması ile oluşur.
Kovalent Bağ
Polar Kovalent Bağ Apolar Kovalent Bağ
Molekülde elektron yük dağılımı Aynı tür atomların elektronegatiflik
homojen değil de bir atom üzerine değerleri aynı olduğundan ortak
yoğunlaşmışsa elektron yoğunluğu kullanılan elektronlar her iki atom
çok olan uç kısmi negatif (�δ), diğer tarafından eşit çekilir. Elektron
uç kısmi pozitif (+δ) olur. Böylece yük yoğunluğu eşit dağıldığı için
kalıcı olarak (+) ve (�) iki kutup kutup oluşmaz. Bu tür bağa apolar
oluşur. Bu tür bağa polar (kutuplu) (kutupsuz) kovalent bağ denir.
kovalent bağ denir.
F F O O N N
H O, BH , NH
2 3 3
MOLEKÜLLERDE POLARLIK
• Merkez atom üzerinde ortaklanmış O
elektron çifti varsa polardır. H H
H
• Merkez atom üzerinde ortaklanmış B
elektron çifti yoksa apolardır. H H
38 MEBİ KONU ÖZETLERİ KIMYA - TYT