Page 39 - Konu Özetleri TYT Kimya
P. 39
GÜÇLÜ ETKILEŞIMLER
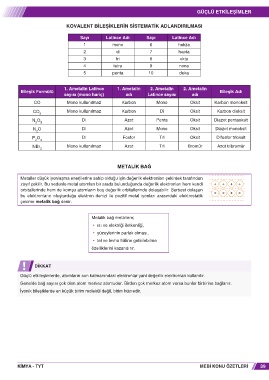
KOVALENT BILEŞIKLERIN SISTEMATIK ADLANDIRILMASI
Sayı Latince Adı Sayı Latince Adı
1 mono 6 hekza
2 di 7 hepta
3 tri 8 okta
4 tetra 9 nona
5 penta 10 deka
1. Ametalin Latince 1. Ametalin 2. Ametalin 2. Ametalin
Bileşik Formülü Bileşik Adı
sayısı (mono hariç) adı Latince sayısı adı
CO Mono kullanılmaz Karbon Mono Oksit Karbon monoksit
CO Mono kullanılmaz Karbon Di Oksit Karbon dioksit
2
N O Di Azot Penta Oksit Diazot pentaoksit
2 5
N O Di Azot Mono Oksit Diazot monoksit
2
P O Di Fosfor Tri Oksit Difosfor trioksit
2 3
NBr Mono kullanılmaz Azot Tri Bromür Azot tribromür
3
METALIK BAĞ
Metaller düşük iyonlaşma enerjilerine sahip olduğu için değerlik elektronları çekirdek tarafından
zayıf çekilir. Bu nedenle metal atomları bir arada bulunduğunda değerlik elektronları hem kendi + + + +
orbitallerinde hem de komşu atomların boş değerlik orbitallerinde dolaşabilir. Serbest dolaşan + + + +
bu elektronların oluşturduğu elektron denizi ile pozitif metal iyonları arasındaki elektrostatik
çekime metalik bağ denir.
Metalik bağ metallere;
• ısı ve elektriği iletkenliği,
• yüzeylerinin parlak olması,
• tel ve levha hâline getirilebilme
özelliklerini kazandırır.
DIKKAT
Güçlü etkileşimlerde, atomların son katmanındaki elektronlar yani değerlik elektronları kullanılır.
Genelde bağ sayısı çok olan atom merkez atomudur. Birden çok merkez atom varsa bunlar birbirine bağlanır.
İyonik bileşiklerde en küçük birim molekül değil, birim hücredir.
KIMYA - TYT MEBİ KONU ÖZETLERİ 39