Page 140 - DEFTERİM KİMYA 10
P. 140
3. Ünite: Asitler, Bazlar ve Tuzlar
Notlarım
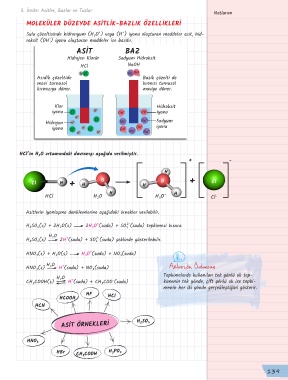
MOLEKÜLER DÜZEYDE ASİTLİK-BAZLIK ÖZELLİKLERİ
+ +
Sulu çözeltisinde hidronyum (H 3 O ) veya (H ) iyonu oluşturan maddeler asit, hid-
-
roksit (OH ) iyonu oluşturan maddeler ise bazdır.
Hidrojen Klorür Sodyum Hidroksit
HCl NaOH
Asidik çözeltide Bazik çözelti de
mavi turnusol kırmızı turnusol
kırmızıya döner. maviye döner.
Klor Hidroksit
iyonu iyonu
Sodyum
Hidrojen
iyonu iyonu
HCl’in H 2 O ortamındaki davranışı aşağıda verilmiştir.
+ -
H
O O +
Cl H + H H Cl
H + H
HCl H 2 O H 3 O Cl -
Asitlerin iyonlaşma denklemlerine aşağıdaki örnekler verilebilir.
+
2-
H 2 SO 4 (s) + 2H 2 O(s) 2H 3 O (suda) + SO 4 (suda) tepkimesi kısaca
H 2 O
+
2-
H 2 SO 4 (s) 2H (suda) + SO 4 (suda) şeklinde gösterilebilir.
+ -
HNO 3 (s) + H 2 O(s) H 3 O (suda) + NO 3 (suda)
H 2 O + - Aklınızda Bulunsun
HNO 3 (s) H (suda) + NO 3 (suda)
Tepkimelerde kullanılan tek yönlü ok tep-
H 2 O
-
+
CH 3 COOH(s) H (suda) + CH 3 COO (suda) kimenin tek yönde, çift yönlü ok ise tepki-
menin her iki yönde gerçekleştiğini gösterir.
HF HCl
HCOOH
HCN
ASİT ÖRNEKLERİ H 2 SO 4
HNO 3
HBr CH 3 COOH H 3 PO 4
139