Page 141 - DEFTERİM KİMYA 10
P. 141
3. Ünite: Asitler, Bazlar ve Tuzlar
Notlarım
+
Oksijence zengin olan ametal oksitler (CO 2 , SO 2 ve N 2 O 5 gibi), yapısında H iyonu
+
içermediği hâlde su ile tepkimeye girdiğinde H 3 O oluşturur. Bu nedenle asit gibi
davranır.
+ 2-
CO 2 (g) + 3H 2 O(s) 2H 3 O (suda) + CO 3 (suda)
+
2-
SO 2 (g) + 3H 2 O(s) 2H 3 O (suda) + SO 3 (suda)
-
+
N 2 O 5 (g) + 3H 2 O(s) 2H 3 O (suda) + 2NO 3 (suda)
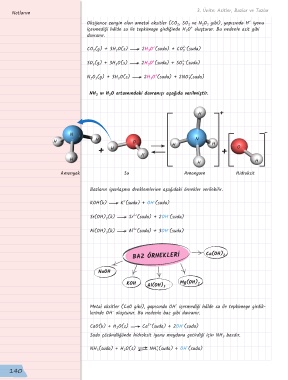
NH 3 ın H 2 O ortamındaki davranışı aşağıda verilmiştir.
H +
-
N
H H O N
H H O
+ H +
H
H H
H
Amonyak Su Amonyum Hidroksit
Bazların iyonlaşma denklemlerine aşağıdaki örnekler verilebilir.
+ -
KOH(k) K (suda) + OH (suda)
2+
-
Sr(OH) 2 (k) Sr (suda) + 2OH (suda)
-
3+
Al(OH) 3 (k) Al (suda) + 3OH (suda)
BAZ ÖRNEKLERİ Ca(OH) 2
NaOH
KOH Mg(OH) 2
Al(OH) 3
-
Metal oksitler (CaO gibi), yapısında OH içermediği hâlde su ile tepkimeye girdik-
-
lerinde OH oluşturur. Bu nedenle baz gibi davranır.
2+ -
CaO(k) + H 2 O(s) Ca (suda) + 2OH (suda)
Suda çözündüğünde hidroksit iyonu meydana getirdiği için NH 3 bazdır.
+ -
NH 3 (suda) + H 2 O(s) NH 4 (suda) + OH (suda)
140