Page 15 - Kimya
P. 15
Kimya 9. Sınıf
HİDROJEN BAĞININ KAYNAMA NOKTASINA ETKİSİ
Moleküller arası çekim kuvvetleri bir maddenin fiziksel özelliklerini belirler. Katı bir maddeyi sıvı
hâle getirmek veya bir sıvıyı buharlaştırmak için moleküller arası (zayıf etkileşim) çekim kuvvetini
yenmek gerekir. Bu çekim kuvvetini yenmek onları bir arada tutan kuvvetten daha büyük bir enerji ver-
mekle mümkün olur. Moleküller arası çekim kuvveti ne kadar büyük olursa verilmesi gereken enerji de
o kadar fazla olur.
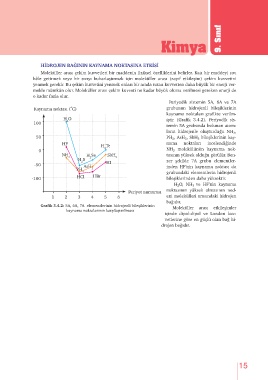
Periyodik sistemin 5A, 6A ve 7A
o grubunun hidrojenli bileşiklerinin
Kaynama noktası ( C)
kaynama noktaları grafikte verilm-
H O iştir (Grafik 3.4.2). Periyodik sis-
100 2
temin 5A grubunda bulunan atom-
ların hidrojenle oluşturduğu NH 3 ,
50 PH 3 , AsH 3 , SbH 3 bileşiklerinin kay-
HF nama noktaları incelendiğinde
H Te
2 NH 3 molekülünün kaynama nok-
0
NH H Se SbH tasının yüksek olduğu görülür. Ben-
3 2 3
H S zer şekilde 7A grubu elementler-
2 HI
-50 AsH inden HF’nin kaynama noktası da
PH 3
3 grubundaki elementlerin hidrojenli
HCl HBr
-100 bileşiklerinden daha yüksektir.
H 2 O, NH 3 ve HF’nin kaynama
noktasının yüksek olmasının ned-
Periyot numarası
1 2 3 4 5 6 eni molekülleri arasındaki hidrojen
bağıdır.
Grafik 3.4.2: 5A, 6A, 7A elementlerinin hidrojenli bileşiklerinin Moleküller arası etkileşimler
kaynama noktalarının karşılaştırılması
içinde dipol-dipol ve London kuv-
vetlerine göre en güçlü olan bağ hi-
drojen bağıdır.
15