Page 28 - Fen Lisesi Kimya 11 | 4. Ünite
P. 28
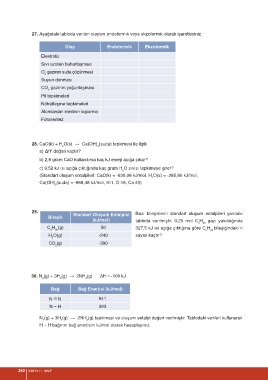
27. Aşağıdaki tabloda verilen olayları endotermik veya ekzotermik olarak işaretleyiniz.
Olay Endotermik Ekzotermik
Elektroliz
Sıvı azotun buharlaşması
O gazının suda çözünmesi
2
Suyun donması
CO gazının yoğunlaşması
2
Pil tepkimeleri
Nötralleşme tepkimeleri
Atomlardan elektron koparma
Fotosentez
28. CaO(k) + H O(s) → Ca(OH) (suda) tepkimesi ile ilgili
2 2
o
a) ∆H değeri kaçtır?
b) 2,8 gram CaO kullanılırsa kaç kJ enerji açığa çıkar?
c) 9,52 kJ ısı açığa çıktığında kaç gram H O sıvısı tepkimeye girer?
2
(Standart oluşum entalpileri: CaO(k) = -635,08 kJ/mol, H O(s) = -285,80 kJ/mol,
2
Ca(OH) (suda) = -968,48 kJ/mol, H:1, O:16, Ca:40)
2
29.
Standart Oluşum Entalpisi Bazı bileşiklerin standart oluşum entalpileri yandaki
Bileşik
(kJ/mol) tabloda verilmiştir. 0,25 mol C H gazı yakıldığında
n 2n
C H (g) 50 327,5 kJ ısı açığa çıktığına göre C H bileşiğindeki n
n 2n n 2n
H O(g) -240 sayısı kaçtır?
2
CO (g) -390
2
30. N (g) + 3H (g) → 2NH (g) ∆H = -109 kJ
2 2 3
Bağ Bağ Enerjisi (kJ/mol)
N ≡ N 941
N − H 393
N (g) + 3H (g) → 2NH (g) tepkimesi ve oluşum entalpi değeri verilmiştir. Tablodaki verileri kullanarak
2 2 3
H − H bağının bağ enerjisini kJ/mol olarak hesaplayınız.
262 KİMYA 11. SINIF