Page 24 - Fen Lisesi Kimya 11 | 4. Ünite
P. 24
4. ÜNİTE ÖLÇME VE DEĞERLENDİRME
A Aşağıda verilen bilgilere göre soruları cevaplandırınız.
TEPKİME ENTALPİSİ
o
Maddelerin entalpi değerleri, genel olarak 25 C sıcaklık ve 1 atm basınçta ölçülür. Bu değerlere standart
entalpi denir. Bir bileşiğin standart koşullarda elementlerinden oluştuğu tepkimenin entalpisine bileşiğin
standart oluşum entalpisi denir. Elementlerin en kararlı hâllerinin standart oluşum entalpileri sıfırdır.
Tepkimelerin entalpi değerleri, oluşum entalpilerinden yararlanarak aşağıdaki formülle hesaplanabilir:
o
∆H = ∑nH – ∑nH o
ü g
Tepkime entalpisi, kimyasal bir tepkimede enerji değişimi reaktiflere ait bağların kırılma enerjileri toplamı
ile ürünlerin bağlarının oluşma enerjileri arasındaki farka eşittir. Tepkimelerin entalpi değerleri bağ enerjile-
rinden yararlanarak aşağıdaki formülle hesaplanabilir:
o
∆H = [H o - H o ]
kırılan bağ enerjileri oluşan bağ enerjileri
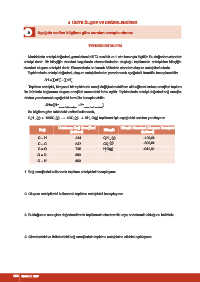
Bu bilgilere göre tablodaki verileri kullanarak,
C H (g) + 13/2O (g) → 4CO (g) + 5H O(g) tepkimesi için aşağıdaki soruları yanıtlayınız.
4 10 2 2 2
Ortalama Bağ Enerjileri Bileşik Standart Oluşum Entalpisi
Bağ Bileşik
(kJ/mol) (kJ/mol)
C − H 414 C H (g) -125,60
4 10
C − C 347 CO (g) -393,50
2
C = O 745 H O(g) -241,80
2
O = O 499
O − H 460
1. Bağ enerjilerini kullanarak tepkime entalpisini hesaplayınız.
2. Oluşum entalpilerini kullanarak tepkime entalpisini hesaplayınız.
3. Bulduğunuz sonuçları değerlendirerek tepkimenin ekzotermik veya endotermik olduğunu belirtiniz.
4. Girenlerdeki ve ürünlerdeki bağ enerjilerinin tepkime entalpisine etkisini açıklayınız.
258 KİMYA 11. SINIF