Page 16 - Kimya 11 | Kazanım Kavrama Etkinlikleri
P. 16
Ortaöğretim Genel Müdürlüğü KİMYA 11 3
4. ÜNİTE: Kimyasal Tepkimelerde Enerji
Konu Tepkime Entalpileri 20 dk.
Kazanımlar 11.4.2.1. Standart oluşum entalpileri üzerinden tepkime entalpilerini hesaplar, tepkime entalpisi potansiyel enerji-tepki-
me koordinatı grafiği üzerinden açıklanır.
1. Yönerge Standart oluşum entalpisi tanımlanır, örnek soru üzerinden kısaca açıklanır, potansiyel enerji-tepki-
me koordinatı grafikleri üzerinden entalpi değerleri gösterilir.
Tepkimeler sabit basınç altında oluşturulduğunda açığa çıkan veya alınan ısı entapi (H) olarak adlandı-
rılır. Eğer maddenin erimesi ile ilgili ısı değişiminden bahsediliyorsa erime entalpisi, buharlaşması ile
ilgili ısı değişiminden söz ediliyorsa buharlaşma entalpisi adı verilir. Gerçekleşen tepkimenin türüne
göre yanma entalpisi, oluşma entalpisi, çözünme entalpisi gibi adlar alır.
Bir mol bileşiğin standart koşullarda (25˚C sıcaklık ve 1atm basınç) bileşiği oluşturan elementlerin kararlı
hallerinin bir araya gelmesiyle oluşan tepkimenin ısı değişimine standart molar oluşum entalpisi denir
˚
ve ∆H olarak gösterilir. Elementlerin standart şartlarda kararlı hallerinin oluşum entalpisi sıfır kabul
f
edilir. Bir tepkimeye ait standart entalpi değişimi, standart oluşum entalpileri kullanılarak hesaplanabilir.
Bunun için bileşiklere ait standart molar oluşum entalpileri verilmelidir. Aşağıdaki formül ve bileşiklere
ait standart molar oluşum entalpileri kullanılarak tepkimenin standart entalpi değişimi hesaplanabilir.
∆H ˚ f tepkime = ∑ n ∆H ˚ f (ürünler) − ∑ n ∆H ˚ f (girenler)
• Aşağıdaki örneği inceleyiniz.
CH (g) + 2O (g) CO (g) + 2H O(g) tepkimesinin standart koşullardaki entalpi değişimini hesap-
2
2
4
2
˚
˚
˚
layalım. (∆H CH = -74,85kJ/mol, ∆H CO = -393,52kJ/mol, ∆H H O = -241,80kJ/mol)
f
f
2
2
4
f
˚
∆H = ∑ n ∆H ˚ f (ürünler) − ∑ n ∆H ˚ f (girenler)
f tepkime
∆H ˚ f tepkime = [(-393,52) + (2.-241,80)]-[(-74,85)]
∆H ˚ f tepkime = -802,27kJ
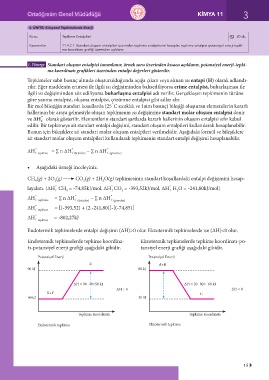
Endotermik tepkimelerde entalpi değişimi (∆H)>0 olur. Ekzotermik tepkimelerde ise (∆H)<0 olur.
Endotermik tepkimelerde tepkime koordina- Ekzotermik tepkimelerde tepkime koordinatı-po-
tı-potansiyel enerji grafiği aşağıdaki gibidir. tansiyel enerji grafiği aşağıdaki gibidir.
Potansiyel Enerji Potansiyel Enerji
Z A+B
90 kJ 80 kJ
∆H = 90−40=50 kJ ∆H = 20−80=−60 kJ
∆H > 0 ∆H < 0
X+Y C
40 kJ 20 kJ
Tepkime Koordinatı Tepkime Koordinatı
Endotermik tepkime Ekzotermik tepkime
15