Page 36 - Kimya 11 | 2.Ünite
P. 36
Gazlar
PV
RT
2,0
1,5
H
2
O
2
1,0 ideal gaz
CO
2
0,5
P (atm)
0 200 400 600 800 1000
Grafik 2.5.1: Farklı gazların PV/RT oranının basınçla değişimi
Grafik 2.5.1ʼde de görüldüğü gibi gerçek gazların ideal gaz değeri-
ne yaklaşması ancak çok düşük basınçlarda geçerlidir. Basınç arttıkça
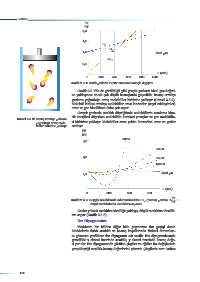
gazların yoğunluğu artar, moleküller birbirine yaklaşır (Görsel 2.5.2).
Molekül kütlesi arttıkça moleküller arası kuvvetler (zayıf etkileşimler)
artar ve gaz ideallikten daha çok sapar.
Gerçek gazlarda sıcaklık düştüğünde moleküllerin ortalama kine-
tik enerjileri düşerken molekülün hareketi yavaşlar ve gaz molekülle-
Görsel 2.5.2: Basınç arttıkça gazların
yoğunluğu artar, mole- ri birbirine yaklaşır. Moleküller arası çekim kuvvetleri artar ve gazlar
küller birbirine yaklaşır sıvılaşır.
PV
RT
200 K
3,0
500 K
2,0 640 K
1000 K
1,0 ideal gaz
P (atm)
0 300 600 900
Grafik 2.5.2: Değişik sıcaklıklarda sabit miktardaki CH 4 (metan) gazının b PV l
RT
düşük sıcaklıklarda ideallikten sapması
Gazlar yüksek sıcaklıkta idealliğe yaklaşır, düşük sıcaklıkta ideallik-
ten sapar (Grafik 2.5.2).
Faz Diyagramları
Maddenin bir hâlden diğer hâle geçmesine faz geçişi denir.
Maddelerin farklı sıcaklık ve basınç koşullarında fiziksel durumları-
nı gösteren grafiklere faz diyagramı adı verilir. Faz diyagramlarında
genellikle x ekseni üzerinde sıcaklık, y ekseni üzerinde basınç değe-
ri yer alır. Faz diyagramında görülen çizgiler ve eğriler faz değişiminin
gerçekleştiği sıcaklık-basınç değerlerini gösterir. Çizgilerin tam üstüne
110