Page 6 - Kimya 11 | 1.Ünite
P. 6
Modern Atom Teorisi
1873 yılında James Clerk Maxwell (Ceyms Klerk Meksvel) ışığın
elektromanyetik dalgalardan oluştuğunu ve elektromanyetik ışımayı
açıklamıştır.
Katılar ısıtıldığında geniş dalga boyu aralığında elektromanyetik ışı-
ma yayar. Bu, ışımanın enerjisinin dalga boyuna bağlı olduğunu gösterir.
1900 yılında Max Planck (Maks Plank) atomların ve molekülle-
rin enerjiyi küçük paketler (kuant) hâlinde yayınlayıp soğurabildiğini
(atomların yayılma spektrumları) açıklamıştır.
1905 Albert Einstein (Albert Aynştayn) metal yüzeyine belli fre-
kansta ışık düşürüldüğünde metal yüzeyden elektron fırlamasını (foto-
elektrik olayı) açıklamıştır.
1913 Niels Bohr (Niıls Bor) Maxwell’in çalışmaları ışığın dalga,
Planck ve Einsteinʼin çalışmaları ise ışığın parçacık özelliği gösterdiğini
ortaya koymuştur.
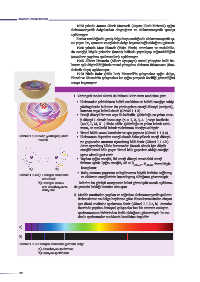
HATIRLAYINIZ
1. Yörüngeli model olarak da bilinen Bohr atom modeline göre
• Elektronlar çekirdekten belirli uzaklıkta ve belirli enerjiye sahip
yörüngelerde bulunur. Bu yörüngelere enerji düzeyi (seviyesi),
katman veya kabuk denir (Görsel 1.1.3).
• Enerji düzeyi bir tam sayı ile belirtilir. Çekirdeğe en yakın ener-
ji düzeyi 1 olmak üzere sayı (n = 1, 2, 3, 4...) veya harflerle
(n=K, L, M, N...) ifade edilir. Çekirdeğe en yakın kabuk mini-
mum, en uzaktaki kabuk maksimum enerjiye sahiptir.
• Temel hâlde atom kararlıdır ve ışın yaymaz (Görsel 1.1.4.a).
Görsel 1.1.3: Bohr (yörüngeli) atom • Elektronun dışarıdan enerji alarak daha yüksek enerji düzeyi-
modeli
ne geçmesine atomun uyarılmış hâli denir (Görsel 1.1.4.b).
Atom uyarılmış hâlde kararsızdır. Kararlı olmak için düşük
enerjili temel hâle geçer. Temel hâle geçerken aldığı enerjiyi
ışıma olarak geri verir.
• Yayılan ışığın enerjisi, iki enerji düzeyi arasındaki enerji
farkına eşittir. Işığın enerjisi, ΔΕ = E yüksek – E düşük formülüyle
hesaplanır.
a) b)
• Bohr, atomun yapısının anlaşılmasına büyük katkılar sağlamış
Görsel 1.1.4: a) Hidrojen atomunun
ve elektron enerjilerinin kuantlaşmış olduğunu göstermiştir.
temel hâli
b) Hidrojen atomu- Bohr’un bu görüşü tartışmasız kabul görmüştür ancak açıklama-
nun absorbsiyon ve da yetersiz kaldığı konular olmuştur.
emisyonu
2. Madde tarafından yayılan ve soğrulan elektromanyetik ışınların
frekanslarına ve dalga boylarına göre düzenlenmesinden oluşan
ışın dizisi analizine spektrum denir (Görsel 1.1.5.a, b). Atomlar
üzerinde yapılan deneysel çalışmalar her bir atomun emisyon
spektrumunun birbirinden farklı olduğunu göstermiştir. Bu ne-
denle spektrumlar maddenin kendisine özgüdür.
a)
b)
Görsel 1.1.5: Hidrojen atomunun görünür bölge,
a) Absorbsiyon spektrumu
b) Emisyon spektrumu
22