Page 16 - Kimya 12 | 1.Ünite
P. 16
1. ÜNITE: KIMYA VE ELEKTRIK
1.2.2. Elektrokimyasal Pil
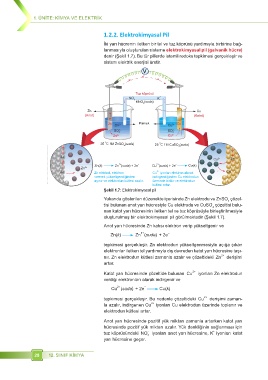
Iki yarı hücrenin iletken bir tel ve tuz köprüsü yardımıyla birbirine bağ-
lanmasıyla oluşturulan sisteme elektrokimyasal pil (galvanik hücre)
denir (Şekil 1.7). Bu tür pillerde istemli redoks tepkimesi gerçekleşir ve
sistem elektrik enerjisi üretir.
v
e -
e - e -
Tuz köprüsü
NO – 3 K +
KNO (suda)
3
Zn Cu
(Anot) (Katot)
e -
Zn Zn 2+ Pamuk Cu 2+ Cu
2- 2-
SO 4 SO 4
2+
Zn 2+ Cu
o
25 C 1M ZnSO (suda) 25 C 1M CuSO (suda)
o
4 4
2e - -
Cu 2+ 2e
2+
2+
Zn(k) Zn (suda) + 2e − Cu (suda) + 2e − Cu(k)
Zn 2+
Zn Zn elektrot, elektron Cu �yonları elektron alarak Cu
2+
vererek yükseltgend�ğ�nden �nd�rgend�ğ�nden Cu elektrodun
aşınır ve elektrodun kütles� azalır. üzer�nde b�r�k�r ve elektrodun
kütles� artar.
Şekil 1.7: Elektrokimyasal pil
Yukarıda gösterilen düzenekte içerisinde Zn elektrodu ve ZnSO çözel-
4
tisi bulunan anot yarı hücresiyle Cu elektrodu ve CuSO çözeltisi bulu-
4
nan katot yarı hücresinin iletken tel ve tuz köprüsüyle birleştirilmesiyle
oluşturulmuş bir elektrokimyasal pil görülmektedir (Şekil 1.7).
Anot yarı hücresinde Zn katısı elektron verip yükseltgenir ve
–
)
Zn(k) Zn 2+ (suda + 2e
tepkimesi gerçekleşir. Zn elektrodun yükseltgenmesiyle açığa çıkan
elektronlar iletken tel yardımıyla dış devreden katot yarı hücresine taşı-
2+
nır. Zn elektrodun kütlesi zamanla azalır ve çözeltideki Zn derişimi
artar.
2+
Katot yarı hücresinde çözeltide bulunan Cu iyonları Zn elektrodun
verdiği elektronları alarak indirgenir ve
−
Cu 2+ (suda + 2e Cu(k)
)
2+
tepkimesi gerçekleşir. Bu nedenle çözeltideki Cu derişimi zaman-
2+
la azalır, indirgenen Cu iyonları Cu elektrodun üzerinde toplanır ve
elektrodun kütlesi artar.
Anot yarı hücresinde pozitif yük miktarı zamanla artarken katot yarı
hücresinde pozitif yük miktarı azalır. Yük denkliğinin sağlanması için
-
+
tuz köprüsündeki NO iyonları anot yarı hücresine, K iyonları katot
3
yarı hücresine geçer.
28 12. SINIF KIMYA