Page 122 - Dört Dörtlük Konu Pekiştirme Testi - AYT KİMYA
P. 122
Koligatif Özellikler - Çözünürlük - Çözünürlüğe
KİMYA Etki Eden Faktörler ÇÖZÜMLÜ SORULAR
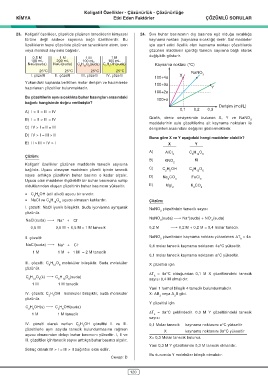
23. Koligatif özellikler, çözeltide çözünen taneciklerin kimyasal 24. Sıvı buhar basıncının dış basınca eşit olduğu sıcaklığa
türüne değil sadece sayısına bağlı özelliklerdir. Bu kaynama noktası (kaynama sıcaklığı) denir. Saf maddeler
özelliklerin hepsi çözeltide çözünen taneciklerin atom, iyon için ayırt edici özellik olan kaynama noktası çözeltilerde
veya molekül sayısına bağlıdır. çözünen maddenin içerdiği tanecik sayısına bağlı olarak
0,5 M 1 M 1 M 1 M değişiklik gösterir.
100 mL 200 mL 100 mL 100 mL
NaCl(suda) NaCl(suda) C H O (suda) C H OH(suda) Kaynama noktası (°C)
5
6
6
2
12
25°C 25°C 25°C 25°C NaNO
I. çözelti II. çözelti III. çözelti IV. çözelti X 3
100+4a
Yukarıdaki kaplarda belirtilen molar derişim ve hacimlerde 100+3a
hazırlanan çözeltiler bulunmaktadır. Y
100+2a
Bu çözeltilerin aynı sıcaklıkta buhar basınçları arasındaki
100+a
bağıntı hangisinde doğru verilmiştir?
Derişim (mol/L)
0,1 0,2 0,3
A) I > II = III = IV
Grafik, deniz seviyesinde bulunan X, Y ve NaNO
B) I = II > III = IV 3
maddelerinin sulu çözeltilerine ait kaynama noktaları ile
C) IV > I = II = III derişimleri arasındaki değişimi göstermektedir.
D) IV > I = III > II
Buna göre X ve Y aşağıdaki hangi maddeler olabilir?
E) II > III = IV > I X Y
A) AlCl 3 C H O 6
12
6
Çözüm:
B) KNO 2 Kl
Koligatif özellikler çözünen maddenin tanecik sayısına
C) C H OH C H O
bağlıdır. Uçucu olmayan maddenin çözelti içinde tanecik 2 5 6 12 6
sayısı arttıkça çözeltinin buhar basıncı o kadar alçalır. D) Na CO FeCl
Uçucu olan maddeler ölçülebilir bir buhar basıncına sahip 2 3 3
olduklarından oluşan çözeltinin buhar basıncını yükseltir. E) MgI 2 K CO 3
2
• C H OH (etil alkol) uçucu bir sıvıdır.
2 5
• NaCl ve C H O uçucu olmayan katılardır.
6 12 6 Çözüm:
I. çözelti: NaCl iyonik bileşiktir. Suda iyonlarına ayrışarak NaNO çözeltisinin tanecik sayısı
çözünür. 3 + -
3
3
NaCl(suda) √ Na + + Cl - NaNO (suda) √ Na (suda) + NO (suda)
0,5 M 0,5 M + 0,5 M = 1 M tanecik 0,2 M √ 0,2 M + 0,2 M = 0,4 molar tanecik
II. çözelti: NaNO çözeltisinin kaynama noktası yükselmesi ¢T = 4a
k
3
NaCl(suda) √ Na + + Cl - 0,4 molar tanecik kaynama noktasını 4a°C yükseltir.
1 M 1 M + 1 M = 2 M tanecik
0,1 molar tanecik kaynama noktasını a°C yükseltir.
III. çözelti: C H O moleküler bileşiktir. Suda moleküler
6 12 6 X çözeltisi için
çözünür.
¢T = 4a°C olduğundan 0,1 M X çözeltisindeki tanecik
k
C H O (k) √ C H O (suda) sayısı 0,4 M olmalıdır.
6
6
12
6
6
12
1 M 1 M tanecik
Yani 1 formül bileşik 4 tanecik bulundurmalıdır.
IV. çözelti: C H OH moleküler bileşiktir, suda moleküler X: AB veya A B gibi.
2 5 3 3
çözünür.
Y çözeltisi için
C H OH(s) √ C H OH(suda)
2
5
5
2
¢T = 3a°C şeklindedir. 0,3 M Y çözeltisindeki tanecik
1 M 1 M tanecik k
sayısı
IV. çözelti olarak verilen C H OH çözeltisi I. ve III. çözeltilerle
2 5 0,1 Molar tanecik kaynama noktasını a°C yükseltir
aynı sayıda tanecik bulundurmasına rağmen C H OH’ın
2 5 X kaynama noktasını 3a°C yükseltir
uçucu olmasından dolayı buhar basıncını yükseltir. I, II ve
X= 0,3 Molar tanecik bulunur.
III. çözeltiler için tanecik sayısı arttıkça buhar basıncı alçalır.
Yani 0,3 M Y çözeltisinde 0,3 M tanecik olmalıdır.
Sonuç olarak IV > I = III > II bağıntısı elde edilir.
Bu durumda Y moleküler bileşik olmalıdır.
Cevap: D
120