Page 149 - Dört Dörtlük Konu Pekiştirme Testi - AYT KİMYA
P. 149
Tepkimelerde Isı Değişimi - Oluşum Entalpisi - Tepkime Isılarının
ÇÖZÜMLÜ SORULAR Toplanabilirliği KİMYA
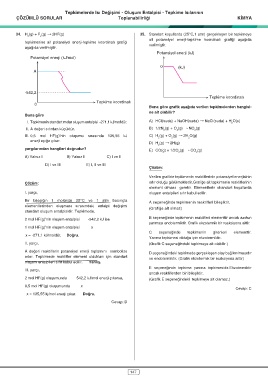
34. H (g) + F (g) † 2HF(g) 35. Standart koşullarda (25°C,1 atm) gerçekleşen bir tepkimeye
2
2
ait potansiyel enerji-tepkime koordinatı grafiği aşağıda
tepkimesine ait potansiyel enerji-tepkime koordinatı grafiği verilmiştir.
aşağıda verilmiştir.
Potansiyel enerji (kJ)
Potansiyel enerji (kJ/mol)
0 (kJ)
A
-542,2
Tepkime koordinatı
Tepkime koordinatı
0
Buna göre grafik aşağıda verilen tepkimelerden hangisi-
ne ait olabilir?
Buna göre
I. HF’ nin standart molar oluşum entalpisi -271,1 kJ/ A) HCI(suda) + NaOH(suda) † NaCI(suda) + H O(s)
2
mol'dür. B) 1/2N (g) + O (g) † NO (g)
2 2 2
II. A değeri sıfırdan küçüktür.
C) H (g) + O (g) † 2H O(g)
2 2 2
III. 0,5 mol HF(g)’nin oluşumu sırasında 135,55 kJ D) H (g) † 2H(g)
enerji açığa çıkar. 2
E) CO(g) + 1/2O (g) † CO (g)
yargılarından hangileri doğrudur? 2 2
A) Yalnız I B) Yalnız II C) I ve II
Çözüm:
D) I ve III E) I, II ve III
Verilen grafikte tepkimenin reaktiflerinin potansiyel enerjisinin
sıfır olduğu görülmektedir.Grafiğe ait tepkimenin reaktiflerinin
Çözüm: element olması gerekir. Elementlerin strandart koşullarda
oluşum entalpileri sıfır kabul edilir.
I. yargı,
A seçeneğinde tepkimenin reaktifleri bileşiktir.
Bir bileşiğin 1 molünün 25°C ve 1 atm basınçta
(Grafiğe ait olmaz)
elementlerinden oluşması sırasındaki entalpi değişimi
standart oluşum entalpisidir. Tepkimede, B seçeneğinde tepkimenin reaktifleri elementtir ancak azotun
2 mol HF(g)’nin oluşum entalpisi -542,2 kJ ise yanması endotermiktir. Grafik ekzotermik bir reaksiyona aittir.
1 mol HF(g)’nin oluşum entalpisi x C seçeneğinde tepkimenin girenleri elementtir.
Yanma tepkimesi olduğu için ekzotermiktir.
x = -271,1 kJ/moldür. Doğru.
(Grafik C seçeneğindeki tepkimeye ait olabilir.)
II. yargı,
D seçeneğindeki tepkimede gerçekleşen olay bağ kırılmasıdır
A değeri reaktiflerin potansiyel enerji toplamını sembolize ve endotermiktir. (Grafik ekzotermik bir reaksiyona aittir)
eder. Tepkimede reaktifler element oldukları için standart
oluşum entalpileri sıfır kabul edilir. Yanlış. E seçeneğinde tepkime yanma tepkimesidir.Ekzotermiktir
ancak reaktiflerden biri bileşiktir.
III. yargı,
(Grafik E seçeneğindeki tepkimeye ait olamaz.)
2 mol HF(g) oluşumunda 542,2 kJ/mol enerji çıkarsa,
Cevap: C
0,5 mol HF(g) oluşumunda x
x = 135,55 kj/mol enerji çıkar. Doğru.
Cevap: D
147