Page 161 - Defterim Kimya - 9
P. 161
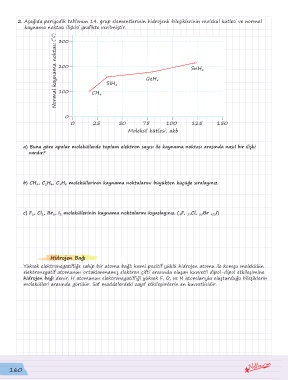
2. Aşağıda periyodik tablonun 14. grup elementlerinin hidrojenli bileşiklerinin molekül kütlesi ve normal
kaynama noktası ilişkisi grafikte verilmiştir.
( 0 C) 300
Normal kaynama noktası 200 CH 4 SiH 4 GeH 4 SnH 4
100
0
0 25 50 75 100 125 150
Molekül kütlesi, akb
a) Buna göre apolar moleküllerde toplam elektron sayısı ile kaynama noktası arasında nasıl bir ilişki
vardır?
, C H , C H moleküllerinin kaynama noktalarını büyükten küçüğe sıralayınız.
b) CH 4 2 6 3 8
c) F , Cl , Br , I moleküllerinin kaynama noktalarını kıyaslayınız. ( F, Cl, Br , I)
2
35
53
9
17
2
2
2
Hidrojen Bağı
Yüksek elektronegatifliğe sahip bir atoma bağlı kısmi pozitif yüklü hidrojen atomu ile komşu molekülün
elektronegatif atomunun ortaklanmamış elektron çifti arasında oluşan kuvvetli dipol-dipol etkileşimine
hidrojen bağı denir. H atomunun elektronegatifliği yüksek F, O, ve N atomlarıyla oluşturduğu bileşiklerin
molekülleri arasında görülür. Saf maddelerdeki zayıf etkileşimlerin en kuvvetlisidir.
Notlarım
Notlarım
160