Page 162 - Defterim Kimya - 9
P. 162
Notlarım
H H H
F
H
N
H
N
N
H H
H H Aynı tür moleküller Farklı tür moleküller H
arasında oluşan arasında oluşan
hidrojen bağı hidrojen bağı H
O
H
H
O
O
H
H
N
H H
H H
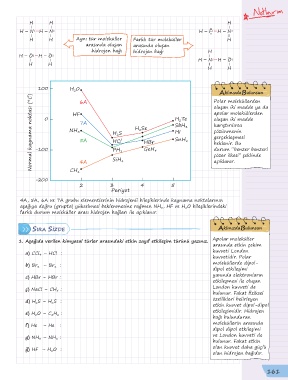
100 H 0 6A Polar moleküllerden
2
A klınızdaB ulunsun
Normal kaynama noktası (°C) -100 NH 3 7A H S 3 H Se 4 H Te 3 4 apolar moleküllerden
oluşan iki madde ya da
HF
0
oluşan iki madde
2
SbH
karıştırılırsa
2
çözünmenin
HI
2
gerçekleşmesi
SnH
5A
HCl
HBr
beklenir. Bu
GeH
durum “benzer benzeri
PH
çözer ilkesi’’ şeklinde
-200 CH 4 4A SiH 4 açıklanır.
2 3 4 5
Periyot
4A, 5A, 6A ve 7A grubu elementlerinin hidrojenli bileşiklerinde kaynama noktalarının
, HF ve H O bileşiklerindeki
aşağıya doğru (grupta) yükselmesi beklenmesine rağmen NH 3 2
farklı durum moleküller arası hidrojen bağları ile açıklanır.
SIRA S ZDE A klınızdaB ulunsun
Apolar moleküller
1. Aşağıda verilen kimyasal türler arasındaki etkin zayıf etkileşim türünü yazınız.
arasında etkin çekim
kuvveti London
a) CCl – HCl :
4
kuvvetidir. Polar
moleküllerde dipol-
b) Br – Br :
2
2
dipol etkileşimi
yanında elektronların
c) HBr – HBr :
etkileşmesi ile oluşan
London kuvveti de
ç) NaCl – CH :
4
bulunur. Fakat fiziksel
özellikleri belirleyen
d) H S – H S :
2
2
etkin kuvvet dipol-dipol
etkileşimidir. Hidrojen
e) H O – C H :
2
2
6
bağı bulunduran
moleküllerin arasında
f) He – He :
dipol dipol etkileşimi
ve London kuvveti de
– NH :
g) NH 3 3
bulunur. Fakat etkin
olan kuvvet daha güçlü
ğ) HF – H O :
2
olan hidrojen bağıdır.
161