Page 98 - Kimya
P. 98
11. Sınıf Kimya
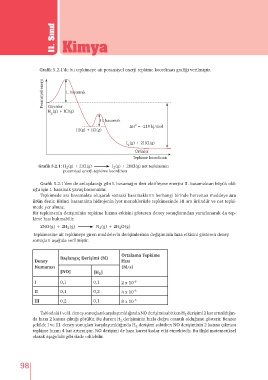
Grafik 5.2.1’de bu tepkimeye ait potansiyel enerji tepkime koordinatı grafiği verilmiştir.
Potansiyel enerji I. basamak
Girenler
H (g) + ICl(g)
2
II. basamak
o
∆H = -218 kj/mol
HI(g) + ICl(g)
I (g) + 2HCl(g)
2
Ürünler
Tepkime koordinatı
Grafik 5.2.1: H (g) + 2ICl(g) I (g) + 2HCl(g) net tepkimenin
2
2
potansiyel enerji-tepkime koordinatı
Grafik 5.2.1’den de anlaşılacağı gibi I. basamağın ileri aktifleşme enerjisi II. basamaktan büyük old-
uğu için I. basamak yavaş basamaktır.
Tepkimede ara basamakta oluşarak sonraki basamakların herhangi birinde harcanan maddeye ara
ürün denir. Birinci basamakta hidrojenin iyot monoklorürle tepkimesinde HI ara üründür ve net tepki-
mede yer almaz.
Bir tepkimenin derişiminin tepkime hızına etkisini gösteren deney sonuçlarından yararlanarak da tep-
kime hızı bulunabilir.
2NO(g) + 2H (g) N (g) + 2H O(g)
2
2
2
tepkimesine ait tepkimeye giren maddelerin derişimlerinin değişiminin hıza etkisini gösteren deney
sonuçları aşağıda verilmiştir.
Ortalama Tepkime
Başlangıç Derişimi (M)
Deney Hızı
Numarası (M/s)
[NO] [H ]
2
I 0,1 0,1 2 x 10 -6
II 0,1 0,2 4 x 10 -6
III 0,2 0,1 8 x 10 -6
Tablodaki I ve II. deney sonuçları karşılaştırıldığında NO derişimi sabitken H derişimi 2 kat artırıldığın-
2
da hızın 2 katına çıktığı görülür. Bu durum H derişiminin hızla doğru orantılı olduğunu gösterir. Benzer
2
şekilde I ve III. deney sonuçları karşılaştırıldığında H derişimi sabitken NO derişiminin 2 katına çıkması
2
tepkime hızını 4 kat artırmıştır. NO derişimi de hıza karesi kadar etki etmektedir. Bu ilişki matematiksel
olarak aşağıdaki gibi ifade edilebilir.
98