Page 25 - Fen Lisesi Kimya 11
P. 25
MODERN ATOM TEORİSİ
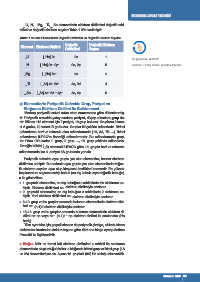
Li, N, Mg, Ti, Se elementlerin elektron dizilimleri değerlik orbi-
3 7 12 22 34
talleri ve değerlik elektron sayıları Tablo 1.3’te verilmiştir.
Tablo 1.3: Bazı Elementlerin Değerlik Orbitalleri ve Değerlik Elektron Sayıları
Değerlik Değerlik Elektron
Element Elektron Dizilimi
Orbitalleri Sayısı
Li [ He] 2s 1 2s 1
3 2
N [ He] 2s 2p 3 2s, 2p 5
2
7 2
Mg [ Ne] 3s 2 3s 2
12 10
2
Ti [ Ar] 4s 3d 2 4s, 3d 4
22 18
10
2
Se [ Ar] 4s 3d 4p 4 4s, 4p 6
34 18
ç) Elementlerin Periyodik Cetvelde Grup, Periyot ve
Bloğunun Elektron Dizilimi ile Belirlenmesi
Modern periyodik cetvel artan atom numarasına göre düzenlenmiş-
tir. Periyodik cetvelde yatay sıralara periyot, düşey sütunlara grup de-
nir. Bilinen 118 element için 7 periyot, 18 grup bulunur. Grupların 8 tane-
si A grubu, 10 tanesi B grubudur. Gruplar iki şekilde adlandırılır. Birinci
adlandırma harf ve rakamla olan adlandırmadır (1A, 3A, 7B …). İkinci
adlandırma IUPAC’ın önerdiği adlandırmadır. Bu adlandırmada grup-
lar 1’den 18’e kadar 1. grup, 2. grup …, 18. grup şeklinde adlandırılır.
Örneğin kükürt ( S) elementi IUPAC’a göre 16. grupta harf ve rakamla
16
adlandırmada ise 3. periyot 6A grubunda yer alır.
Periyodik cetvelde aynı grupta yer alan elementler, benzer elektron
dizilimine sahiptir. Bu nedenle aynı grupta yer alan elementlerin değer-
lik elektron sayıları aynı olup kimyasal özellikleri benzerdir. En yüksek
baş kuantum sayısına sahip kabuk (en dış kabuk veya değerlik kabuğu)
n ile gösterilirse
■ 1. gruptaki elementler, en dış kabuğun s orbitalinde tek elektrona sa-
hiptir. Elektron dizilimleri ns elektron dizilimiyle sonlanır.
1
■ 2. gruptaki elementler, en dış kabuğun s orbitalinde 2 elektrona sa-
hiptir. Yani elektron dizilimleri ns elektron dizilimiyle sonlanır.
2
■ 3-12. grup ve bu gruplar arasında bulunan elementlerin elektron dizi-
2
limi ns (n-1)d elektron dizilimiyle sonlanır.
■ 13-18. grup ve bu gruplar arasında bulunan elementlerin elektron di-
zilimi ns np veya ns (n-1)d np elektron dizilimi ile sonlanırlar (He
2
10
2
hariç).
Tüm ayrıntılar için geçerli olmasa da periyodik çizelge, alt kabukların
elektronlar tarafından dolduruluşuna göre dört ana bloğa ayrılıp Aufbau
Prensibi ile ilişkilendirilir.
s Bloğu: Nötr ve temel hâl elektron dizilimleri s orbitali ile sonlanan
elementlerin oluşturduğu bloktur. s bloğunda birinci grup ve ikinci grup (1A
ve 2A) elementleri yer alır. Ayrıca 18. gruptaki (8A) He s bloğu elementidir.
37
KİMYA 11. SINIF