Page 30 - Fen Lisesi Kimya 12 | 2.Ünite
P. 30
Eten molekülündeki hibrit orbitallerinin ikisi hidrojenle,
diğeri komşu karbon atomuyla örtüşerek sigma (σ) bağını
oluşturur. Karbon atomunun 2p orbitallerinden biri hibritleş-
meye katılmaz. Bu orbital, komşu karbonun hibritleşmemiş
2p orbitaliyle örtüşerek pi (π) bağını oluşturur. Aşağıda eten
molekülündeki orbital örtüşmeleri ile sigma ve pi bağları gö-
rülmektedir (Görsel 2.25).
π
H σ σ H
C σ C
H σ σ H
Görsel 2.25: Eten (C 2 H 4 ) molekülündeki orbital örtüşmeleri ile sigma oluşumu
Karbon atomunun yaptığı sp hibritleşmesi için C 2 H 2 (aseti-
len) molekülü uygun bir örnektir. Bu moleküldeki karbonların
yeni elektron düzeni ve oluşan hibrit orbitallerin enerji düzeyi
şu şekildedir:
102 E Temel hâl Uyarılmış hâl Hibrit orbitaller
2p }
Hibritleşmeye
katılmayan p
2sp orbitalleri
2s sp
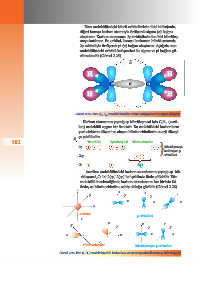
Asetilen molekülündeki karbon atomlarının yaptığı sp hib-
ritleşmesi 6 C: 1s 2(sp) 2(sp) 2p şeklinde ifade edilebilir. Etin
2
1
1
2
molekülü incelendiğinde karbon atomlarının her birinin iki
özdeş sp hibrit orbitaline sahip olduğu görülür (Görsel 2.26).
z
y z y z y
x x x
x
s orbitali p orbitalleri
z
y z y z y z y
x x x x
Hibrit orbitaller Hibritleşmeyen p orbitalleri
Görsel 2.26: Etin (C 2 H 2 ) molekülündeki karbonlara ait 2s ve 2p orbitallerinin sp hibritleşmesi