Page 22 - Kimya 11 | Kazanım Kavrama Etkinlikleri
P. 22
Ortaöğretim Genel Müdürlüğü KİMYA 11 6
5. ÜNİTE: Kimyasal Tepkimelerde Hız
Konu Kimyasal Tepkimeler ile Tanecik Çarpışmaları Arasındaki İlişki 40 dk.
Kazanımlar 11.5.1.1. Kimyasal tepkimeler ile tanecik çarpışmaları arasındaki ilişkiyi açıklar.
Gerekli Materyaller: Çalışma kâğıdı
1. Yönerge
Kimyasal tepkimeler ile tanecik çarpışmaları arasındaki ilişkiyi açıklayan aşağıdaki bilgileri okuyunuz.
Kimyasal tepkimeler reaktiflerin birbirleriyle çarpışmaları sonucu oluşur. Her çarpışma tepkime ile
sonuçlanmaz. Tepkimenin sonuçlanması için etkin çarpışma gerçekleşmesi gerekir. Etkin çarpışma
yeterli kinetik enerji ve uygun geometride çarpışma ile gerçekleşir. Çarpışan reaktiflerin tepkime
verebilmesi için toplam kinetik enerjileri eşik enerjisine (aktifleşme enerjisi) eşit veya eşik enerjisin-
den yüksek olmalıdır. Eşik enerjisi tepkimenin gerçekleşmesi için gerekli en düşük enerjidir. Eşik enerji
değerini kazanmış reaktifler ürünlere dönüşmeden önce kompleks oluşturur. Kararsız ve yüksek enerjili
komplekse aktifleşmiş kompleks denir. Aktifleşmiş kompleksin çoğunluğu ürünlere dönüşerek tepkime
tamamlanır.
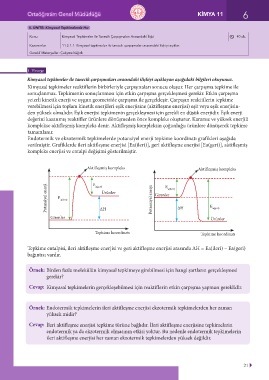
Endotermik ve ekzotermik tepkimelerde potansiyel enerji tepkime koordinatı grafikleri aşağıda
verilmiştir. Grafiklerde ileri aktifleşme enerjisi [Ea(ileri)], geri aktifleşme enerjisi [Ea(geri)], aktifleşmiş
kompleks enerjisi ve entalpi değişimi gösterilmiştir.
Aktifleşmiş kompleks Aktifleşmiş kompleks
E
Potansiyel enerji E a(ileri) E a(geri) Ürünler Potansiyel enerji Girenler a(ileri) ∆H E
a(geri)
Girenler ∆H Ürünler
Tepkime koordinatı Tepkime koordinatı
Tepkime entalpisi, ileri aktifleşme enerjisi ve geri aktifleşme enerjisi arasında ΔH = Ea(ileri) – Ea(geri)
bağıntısı vardır.
Örnek: Birden fazla molekülün kimyasal tepkimeye girebilmesi için hangi şartların gerçekleşmesi
gerekir?
Cevap: Kimyasal tepkimelerin gerçekleşebilmesi için reaktiflerin etkin çarpışma yapması gereklidir.
Örnek: Endotermik tepkimelerin ileri aktifleşme enerjisi ekzotermik tepkimelerden her zaman
yüksek midir?
Cevap: İleri aktifleşme enerjisi tepkime türüne bağlıdır. İleri aktifleşme enerjisine tepkimelerin
endotermik ya da ekzotermik olmasının etkisi yoktur. Bu nedenle endotermik tepkimelerin
ileri aktifleşme enerjisi her zaman ekzotermik tepkimelerden yüksek değildir.
21