Page 37 - Kimya 12 | 1.Ünite
P. 37
3. BÖLÜM: ELEKTROT POTANSIYELLERI
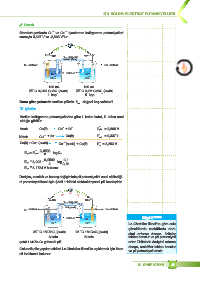
X Örnek
2+
2+
Standart şartlarda Cu ve Ca iyonlarının indirgenme potansiyelleri
X2
sırasıyla 0,337 V ve -2,866 V’tur.
v
Tuz köprüsü
NaNO (suda)
3
Cu elektrot Ca elektrot
Cu Pamuk Ca
2+
2+
2– 2–
SO 4 SO 4
100 mL 100 mL
o
o
25 C 0,01M CuSO (suda) 25 C 0,1M CaSO (suda)
4
4
I. kap II. kap
Buna göre yukarıda verilen pilinin E değeri kaç volttur?
X3 pil
\ özüm
Verilen indirgenme potansiyellerine göre I. kabın katot, II. kabın anot
olduğu görülür.
2+
Anot: Ca(k) Ca + 2e – E o ykü . = 2,866 V
o
2+
–
Katot: Cu + 2e Cu(k) E ind . = 0,337 V
o
Ca(k) + Cu 2+ ( suda) Ca 2+ ( suda) + Cu(k) E = 3,203 V
pil
o
E = E - , 00592 $ logQ c
n
pil
pil
, 01
E = , 3203 - , 00592 $ log , 001
2
pil
E = , 31734 V bulunur .
pil
Derişim, sıcaklık ve basınç değişiminin pil potansiyelini nasıl etkilediği-
ni yorumlayabilmek için Şekil 1.14’teki elektrokimyasal pili inceleyiniz.
v
e – –
e – e
Tuz köprüsü
– +
NO 3 K
KNO (suda)
Zn elektrot 3 Cu elektrot
CI – Pamuk CI – Bilgi Kutusu
2+
Zn 2+ Cu Le Chatelier Ilkesi’ne göre sulu
çözeltilerde reaktiflerin deri-
o
o
25 C 1M ZnCl (suda) 25 C 1M CuCl (suda) şimi artarsa denge, ürünler
2 2
A kabı B kabı lehine bozulur ve pil potansiyeli
Şekil 1.14: Zn-Cu galvanik pili artar. Ürünlerin derişimi artarsa
X4 denge, reaktifler lehine bozulur
Galvanik pile yapılan etkileri Le Chatelier Ilkesi ile açıklamak için önce ve pil potansiyeli azalır.
pil tepkimesi bulunur.
12. SINIF KIMYA 49